На сегодняшний день соединения аминокислот с металлами находят широкое применение в ферментативном катализе, в синтезе новых лекарственных препаратов и биологически активных веществ, а также в разработке новых методов получения экологически чистых катализаторов [1–2].
Широкий спектр работ связан с применением такого рода комплексов в качестве флуоресцентных зондов и меток при исследовании активности ферментов, а также биологических мембран. Применение металлокомплексов аминокислот в области изучения физико-химических процессов, протекающих в биологических системах, связано с тем, что они выступают в качестве моделей реакций белков с металлами [3].
Пероксо- и оксокомплексы металлов с различными лигандами привлекают внимание в качестве простых для моделирования и исследования природных кислородных носителей в биологических процессах [4]. Например, металлоферменты присоединяют оксид при протекании различных биологических процессов [5–6]. Экспериментальные исследования показывают механизмы активации кислорода в таких процессах. Однако точное описание структуры таких комплексов и продуктов реакций экспериментально оценить очень сложно. В связи с этим процессы активации кислорода в биологических процессах изучаются на примере простых модельных соединений – комплексов аминокислот с металлами [7–8].
Активация возбужденных состояний молекулярного кислорода под влиянием различных лигандов, выступающих в роли фотосенсибилизаторов, изучена достаточно подробно [9–10]. Известно, что генерация синглетного кислорода за счет переноса энергии от возбужденной молекулы фотосенсибилизатора и излучательного синглет-триплетного перехода молекулы кислорода с излучением кванта света. В данной работе исследуются процессы генерации синглетного кислорода под влиянием комплексов иона Sn2+ с такими аминокислотами, как цистеин, триптофан, тирозин. Основное состояние кислорода описывается триплетным термом X3Σ-g. Катион олова Sn2+ с конфигурацией внешнего электронного уровня 4d105s2 находится в основном синглетном состоянии 1S0 так же, как и применяемые в работе аминокислоты. Предполагается, что комплекс олова с аминокислотами, как молекула фотосенсибилизатора, при фотовозбуждении должен переходить из основного синглетного состояния в возбужденное триплетное. Далее энергия возбужденной молекулы фотосенсибилизатора за счет быстрого перехода ее в основное состояние передается молекуле кислорода, в результате чего происходит генерация синглетного кислорода за счет Т-S перехода в молекуле О2. Триптофан обладает из всех 20 протеиногенных аминокислот наиболее сильной флуоресценцией, поглощая электромагнитное излучение с длиной волны 280 нм и сольватохромно излучая в диапазоне 300–350 нм [11]. Тирозин обладает высокой антиоксидантной активностью, что может проявляться в тушении радикалов, образующихся в реакциях синглетного кислорода с биологическими фрагментами. Цистеин является серосодержащей аминокислотой (в составе тиольной группы), что обуславливает высокую устойчивость данной аминокислоты в комплексах с металлами (константа устойчивости lg β2 с никелем ~ 20,2, цинком ~ 18,2), большую, чем у других аминокислот [12].
Материалы и методы исследования
Геометрическая оптимизация комплексов 1[Cys--Sn2+-Cys-], 1[Trp--Sn2+-Trp-], 1[Tyr--Sn2+-Tyr-] рассчитана методом ROHF/B3Lyp в базисе DZP, последующая оптимизация комплексов при присоединении молекулы кислорода проведена в базисе 3-21G [13]. Моделирование энергетических термов основных и нескольких возбужденных состояний оксигенированных комплексов проводили методом MRCI с учетом двукратных возбуждений, на векторах, полученных в рамках метода ROHF/B3Lyp/3-21G. В активное пространство (АП) включены 30 электронов, расположенных по орбиталям 3σg2 πu2 πu2 πg1 πg1 3σu0 молекулы O2 и 4dxy, 4dyz, 4dxz, 3dx2-y2, 3dz2, 5s, 5px, 5py, 5pz катиона Sn2+. За координату реакции принято расстояние R(Sn-O) между металлом и ближайшим к нему атомом кислорода в молекуле О2. Моменты разрешенных S-S, T-T переходов и запрещенных S-T переходов рассчитаны на основе оператора спинорбитального взаимодействия в одночастичном приближении оператора СОВ. Все расчеты выполнены в пакете программ FireFly [14].
Результаты исследования и их обсуждение
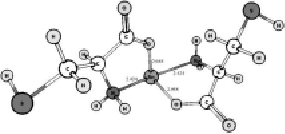
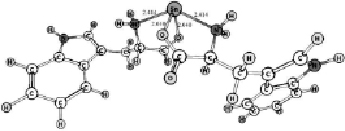
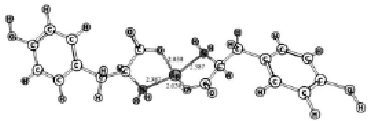
Конформационный анализ комплексов катиона олова с молекулами триптофана, цистеина и тирозина показал, что во всех случаях наиболее выгодной является конформация, когда катион расположен между амино- и карбоксильной группами (рис. 1). Основное состояние комплексов – синглетное. Симметрия – C2v.
Таблица 1
Геометрические характеристики металлокомплексов аминокислот с молекулой кислорода, полученные в ходе оптимизации методом ROHF в базисе 3-21 G
|
Комплекс |
R(Sn-N(NH2)) |
R(Sn-O(COO)) |
R(Sn-O(O2)) |
Группа симметрии |
|
1[Cys--Sn2+-Cys-+О2] |
2,036 |
2,378 |
3,960 |
С2 |
|
3[Cys--Sn2+-Cys-+О2] |
2,240 |
2,047 |
2,040 |
С2 |
|
1[Trp--Sn2+-Trp-+О2] |
2,369 |
2,037 |
3,623 |
Сs |
|
3[Trp--Sn2+-Trp-+О2] |
2,035 |
2,375 |
3,760 |
Сs |
|
1[Tyr--Sn2+-Tyr-+О2] |
2,185 |
1,988 |
1,974 |
С2 |
|
3[Tyr--Sn2+-Tyr-+О2] |
2,246 |
2,040 |
1,419 |
С2 |
А
Б
В
Рис. 1. Геометрическое строение комплексов, полученное в ходе геометрической оптимизации методом ROHF/DZP: А – 1[Cys--Sn2+-Cys-], Б – 1[Trp--Sn2+-Trp-], В – 1[Tyr--Sn2+-Tyr-]
Молекулу кислорода ориентировали к катиону металла в комплексе, проводя при этом геометрическую оптимизацию оксигенированных комплексов как в основном триплетном, так и в возбужденном синглетном состояниях. Равновесные расстояния в комплексах и группа симметрии приведены в табл. 1.
В случае с триптофаном симметрия С2v в комплексе 3[Trp--Sn2+-Trp-] сохраняется, однако молекула кислорода удаляется на расстояние 3,8A, ориентация молекулы кислорода к комплексу напоминает структуру пероксокомплекса. В комплексах с цистеином в синглетном состоянии, а также триптофаном как в синглетном, так и в триплетном состояниях молекула кислорода наиболее удалена от комплекса, длина связи составляет порядка 3-4 A. Объяснение такому диссоциативному взаимодействию может дать анализ сечений ППЭ основных и возбужденных состояний комплексов.
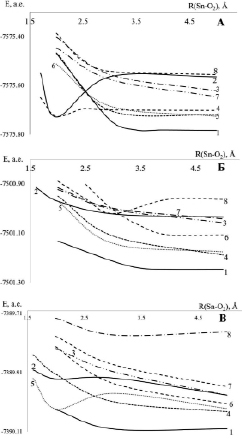
Анализ сечений ППЭ (рис. 2) показывает, что основным термом во всех комплексах является диссоциативный терм, описывающий основное триплетное состояние кислорода 3[Sn(1S0)-3Ʃ-g(O2)] (кривая 1). В комплексе 1,3[Cys--Sn2+-Cys-+O2] к нему примыкают синглетные термы a1Δg и 1a′Δ′g кислорода – 1[Sn(1S0)-О2(1Δ’g)] и 1[Sn(1S0)-О2(1Δg)] (кривые 5, 6), которые остаются диссоциативными на всем интервале R(Sn-O2).
Терм синглетного кислорода b1Σg+ –1[Sn(1S0)-О2(1Ʃ+g)] (кривая 4) обладает небольшим минимумом в точке 2A с энергией диссоциации порядка 0,65 эВ. Примыкающими к нему являются термы, описывающие состояние переноса заряда (СПЗ) (кривая 2, 8), при котором происходит перенос электрона с 5S2 катиона Sn2+ на πg1 в триплете или πg 0 в синглете молекулы О2.Энергия активации СПЗ составляет 0,99 эВ (в точке пересечения основного триплетного терма с термом СПЗ в точке 2,4 A). Таким образом, образование комплекса 3[Cys--Sn2+-Cys-+О2] в основном триплетном состоянии возможно в ходе возникновения СПЗ (Sn+-O2-). Далее из СПЗ возможно образование синглетного кислорода при переходе на терм b1Ʃ+g. Однако наряду с образованием СПЗ равновероятным процессом является генерация состояний a’1Δ’g и a1Δg (пересечение основного триплетного терма 1 с кривыми 5, 6). Энергия активации данных состояний также равна порядка 0,99 эВ.
|
|
А – 1,3[Cys-–Sn2+–Cys-+O2]: 1 – 3[1Cys-Sn(1S0)-1Cys–3Ʃ-g (O2)]; 2 – СПЗ 3[1Cys-Sn1,5+-1Cys–O20,5-]; 3 – 3[1Cys-Sn(3P0)-1Cys–3(O2)]; 4 – 1[1Cys-Sn(1S0)-1Cys –О2(1Ʃ+g)] 5 – 1[1Cys-Sn(1S0)-1Cys – О2(1Δ’g)] 6 – 1[1Cys-Sn(1S0)-1Cys – О2(1Δg)] 7 – 1[1Cys-Sn(3P0)-1Cys–O2]; 8 – СПЗ 3[1Cys-Sn+-1Cys–O2-]. |
|
Б – 1,3[Trp-–Sn2+–Trp-+O2]: 1 – 3[1Trp -Sn(1S0)-1Trp–3Ʃ-g(O2)]; 2 – СПЗ 3[1Trp-Sn1,5+-1Trp–O20,5-]. 3 – 3[1Trp-Sn(3P0)-1Trp–3(O2)]; 4 – 1[1Trp-Sn(1S0)-1Trp – О2(1Δ’g)] 5 – 1[1Trp-Sn(1S0)-1Trp – О2(1Δg)] 6 – 1[1Trp-Sn(1S0)-1Trp–О2(1Δ+g)] 7 – 1[1Trp-Sn(1S1/2)-1Trp–O2]; 8 – СПЗ 3[1Trp-Sn+-1Trp–O2-]. |
|
|
В – 1,3[Tyr-–Sn2+–Tyr-+O2]: 1 – 3[1Tyr -Sn(1S0)-1Tyr–3Ʃ-g(O2)]; 2 – СПЗ 3[1Tyr-Sn1,5+-1Tyr–O20,5-]; 3 – 3[1Tyr-Sn(3P0)-1Tyr –3(O2)]; 4 – 1[1Tyr-Sn(1S0)-1Tyr – О2(1Δ’g)] 5 – 1[1Cys-Sn(1S0)-1Cys – О2(1Δg)] 6 – 1[1Tyr-Sn(1S0)-1Tyr –О2(1Δ+g)] 7 – 1[1Tyr-Sn(1S1/2)-1Tyr–O2]; 8 – СПЗ 1[1Tyr-Sn+-1Tyr–O2-]. |
Рис. 2. Сечения ППЭ комплексов 1,3[Sn2+-2АК-+O2], рассчитанные методом CI в базисе 3-21G
Таблица 2
Величины моментов переходов для переходов в комплексах с катионом Sn2+
|
Комплекс |
Переход |
M, D |
|
1,3[Cys-–Sn2+–Cys-+O2] |
(СПЗ 3[Sn+O2-]– 1a') |
2,6?*10-1 |
|
(СПЗ 3[Sn+O2-]– 1a) |
1,0*10-3 |
|
|
(СПЗ 3[Sn+O2-]– 1b) |
3,0*10-1 |
|
|
(СПЗ 3[Sn+O2-]– Х) |
9,5*10-5 |
|
|
1,3[Trp-–Sn2+–Trp-+O2] |
(СПЗ 3[Sn+O2-]– 1b) |
1,2*10-4 |
|
(СПЗ 3[Sn+O2-]– Х) |
2,6*10-6 |
|
|
1,3[Tyr-–Sn2+–Tyr-+O2] |
(СПЗ 3[Sn+O2-]– 1a’) |
0,8*10-1 |
|
(СПЗ 3[Sn+O2-]– 1a) |
1,0*10-3 |
|
|
(СПЗ 3[Sn+O2-]– 1b) |
1,0*10-1 |
|
|
(СПЗ 3[Sn +O2-]– Х) |
6,2*10-6 |
Совсем иная картина наблюдается в комплексе с триптофаном. В комплексе 1,3[Trp-–Sn2+–Trp-+O2] (рис. 3, Б) все синглетные термы 1[Sn(1S0)-21Trp – О2(1Δ’g)], 1[Sn(1S0)-21Trp – О2(1Δg)], 1[1Trp-Sn(1S0)-1Trp–О2(1Δ+g)] (кривые 4, 5, 6) так же, как и основной триплетный терм 3[1Trp -Sn(1S0)-1Trp–3Ʃ-g(O2)], диссоциативны на всем интервале R(Sn-O2), что объясняет удаление молекулы кислорода от комплекса [Trp-Sn-Trp] в ходе геометрической оптимизации (табл. 1). В комплексе 1,3[Trp-–Sn2+–Trp-+O2] (рис. 1, Б) все синглетные термы 1[Sn(1S0)-21Trp – О2(1Δ’g)], 1[Sn(1S0)-21Trp – О2(1Ʃg)], 1[1Trp-Sn(1S0)-1Trp–О2(1Ʃ+g)] (кривые 4, 5, 6) так же, как и основной триплетный терм 3[1Trp-Sn(1S0)-1Trp– 3Ʃ-g(O2)], диссоциативны на всем интервале R(Sn-O2), что объясняет удаление молекулы кислорода от комплекса [Trp-Sn-Trp] в ходе геометрической оптимизации (табл. 1). Все термы так же, как и основной триплетный терм кислорода 3Ʃ-g, диссоциативны на всем интервале R(Sn-O2), что объясняет удаленность молекулы кислорода от комплекса по результатам геометрической оптимизации (табл. 1). Однако небольшим энергетическим минимумом обладают термы, описывающие состояние переноса заряда в комплексе в синглетном и триплетном состояниях (кривые 2, 8), но необходимо затратить энергию для возникновения СПЗ порядка 3–4 эВ. В результате образования СПЗ возможна генерация синглетного кислорода в состоянии b1Ʃ+g (при переходе с кривой 7 или 8 на кривую 6), однако такой механизм энергетически не выгоден.
В комплексе 1,3[Tyr-–Sn2+–Tyr-+O2] (рис. 3, В) наблюдается минимум для синглетного состояния 1[1Tyr-Sn(1S0)-1Tyr –О2(1Ʃ+g)] (кривая 5). В точке пересечения с данным термом основного триплетного терма 3[1Tyr -Sn(1S0)-1Tyr–3Ʃ-g(O2)] (кривая 1) возможно образование синглетного кислорода. Это наиболее энергетический выгодный путь генерации синглетного кислорода в данном комплексе с энергией активации 1,8 эВ. Однако существует еще один возможный механизм генерации кислорода в синглетном состоянии за счет образования состояния переноса заряда в триплете СПЗ 3[1TyrSn+-1Tyr–O2-] (кривая 2). Энергия активации такого СПЗ гораздо выше и составляет порядка 3,8 эВ. Далее терм СПЗ, пересекаясь с термами a1Δg и b1Ʃ+g (кривые 4, 6), может также инициировать синглетный кислород. Оценка моментов переходов позволяет сделать вывод об индуцировании запрещенных по спину переходов между триплетным СПЗ в комплексах и синглетными термами молекулы О2 (табл. 3). Данные сведения подтверждают исследуемый в данных комплексах механизм генерации синглетного кислорода.
Заключение
Резюмируя, можно отметить, что во всех исследуемых комплексах выявлены устойчивые состояния переноса заряда, наблюдаемые за счет переноса электрона с 5S2 катиона Sn2+ на πg1 в триплете или πg0 в синглете. Генерация синглетного кислорода возможна в ходе образования таких СПЗ, однако наиболее энергетически выгодным такой канал генерации является в комплексе с цистеином. В случае с триптофаном и тирозином такие переходы требуют больших затрат энергии. В комплексе с тирозином наиболее приемлемым можно считать образование синглетного кислорода в точке пересечения триплетного терма 3Ʃ-g с синглетным термом a’1Δ’g.
Статья выполнена при поддержке гранта Оренбургской области в сфере научной и научно-технической деятельности № 22 от 2017 г.
Библиографическая ссылка
Пешкова Т.В., Пешков С.А. ВЛИЯНИЕ КАТИОНА ОЛОВА В КОМПЛЕКСАХ С АМИНОКИСЛОТАМИ НА ПРОЦЕСС ГЕНЕРАЦИИ СИНГЛЕТНОГО КИСЛОРОДА // Успехи современного естествознания. 2018. № 1. С. 7-12;URL: https://natural-sciences.ru/ru/article/view?id=36643 (дата обращения: 21.02.2026).