Известно, что хлорофилл а и его производные не только играют значительную роль в живой природе, но и могут быть использованы в качестве исходных веществ для синтеза практически важных соединений, находящих применение в медицине [1–3], катализе [4, 5], конструировании полимерных и наноматериалов для фотоэлектроники [6] и других областях. В связи с этим изучение химических превращений хлорофилла а и его производных представляет большой интерес. Превращение винильной группы в положении 3 макроцикла производных хлорофилла а в альдегидную является ключевой стадией в синтезе различных хлоринов. Эту реакцию проводят путем озонолиза или при окислении перйодатом натрия с каталитическими количествами тетраоксида осмия [7]. Известно, что при действии более доступного перманганата калия окисление проходит не селективно с образованием всех возможных продуктов (производных с альдегидной, карбоксильной и диольной группами) [7]. Применение межфазного катализа во многих случаях приводит к повышению выхода продукта реакции, селективности процесса [8]. В связи с этим цель исследования заключалась в изучении окисления винильной группы производных хлорофилла перманганатом калия в условиях межфазного катализа.
Материалы и методы исследования
Спектры ЯМР 1Н полученных веществ записывали на приборах Bruker AM-300 (рабочая частота 300 МГц), Bruker AMХ-400 (рабочая частота 400 МГц) и TESLA BS 587A (рабочая частота 80 МГц) в дейтерохлороформе, ДМФА или дейтерированной воде. ИК-спектры были записаны на приборе «Specord M 80» и MIR-8000(ORIEL) в таблетках KBr (навеска порядка 1–1,5 мг). Электронные спектры поглощения (ЭСП) были записаны на спектрофотометре Lambda 20, фирмы Perkin Elmer в области 350–750 нм в хлороформенном растворе. Для колоночной хроматографии использовали силикагель L 40/100. Метилфеофорбид а (1) и метилпирофеофорбид а (2) получены согласно [9, 10]. Метиламид хлорина е6 (6) получен согласно [11].
Окисление в системе бензол / вода. К раствору 150 мг метилфеофорбида а и 3 мг дибензо-18-краун-6 в 32 мл бензола прибавили раствор 806 мг перманганата калия в 29 мл воды. Смесь перемешивали при комнатной температуре в течение одного часа. За ходом реакции следили при помощи ТСХ (silufol, CCl4:ацетон = 3:1). Реакционную смесь промывали водой для удаления непрореагировавшего перманганата калия, затем эту смесь сушили над безводным сульфатом натрия и упаривали. Остаток после упаривания переосаждали из смеси пентана с бензолом. Выход продукта (метилфеофорбид d) составил 18 мг (12 %). Спектр ЯМР 1Н (CDCl3, 300 МГц), δ, м.д. (3): 11,47 (с 1Н, Н3(1)), 10,21 (c 1H, H10), 9,57 (с 1Н, H5), 8,81 (с 1Н, Н20), 6,32 (c 1H, Н13(2)), 4,0–4,8 (м 1H, Н18), 4,0–4,8 (м 1H, Н17), CH3 (c 3H): 3,89 (с 3Н, Н13(4)), 3,72 (с 3Н, Н12(1)), 3,57 (с 3Н, Н17(4)), 3,38 (с 3Н, Н2(1)), 3,23 (с 3Н, Н7(1)); СН2: 3,65 (м 2Н, Н8(2)), 2,1–2,8 (м 4Н, Н17(1)), 2,1–2,8 (м 4Н, Н17(2)); СН3: 1,84 (d 3H, 8 Гц, Н18(1)), 1,67 (т 3Н, 7,2 Гц, Н8(2)), –1,87 (уш.с. 1Н, III – NH), 11,47 (с 1Н, -СОН). ИК (см-1, KBr): 2700 (nC-Н, альдегидная группа), 1750 (nC=O, сложный эфир), 1718 (nC=O, кето-группа в экзоцикле), 1672 (nC=О, альдегидная группа), 1624 («хлориновая полоса»). ЭСП (СНСl3, λ, нм): 696 (полоса I), 636, 556, 523, 430 (полоса Соре).
К раствору 50 мг 13(N)-метиламида-15,17-диметилового эфира хлорина е6 и 3 мг дибензо-18-краун-6 в 20 мл бензола прибавили раствор 70 мг перманганата калия в 17 мл воды. Смесь перемешивали при комнатной температуре в течение 30 минут (ТСХ: silufol, CCl4:ацетон = 3:1). Реакционную смесь промывали водой в делительной воронке для устранения перманганата калия, затем эту смесь сушили над безводным сульфатом натрия и упаривали. Масса смеси окисленных хлоринов оставила 7,6 мг. Смесь исследовали при помощи ПМР-спектроскопии. Спектр ЯМР 1Н (CDCl3, 300 МГц), δ, м.д.: (6): 9,68 (с 1Н, Н10), 9,63 (с 1Н, Н5), 8,80 (с 1Н, Н20), 8,08 (дд 1Н, 17 и 11,6 Гц, Н3(1)), 6,35 (д 1Н, 18 Гц, Н3(2)транс), 6,14 (д 1Н, 11,6 Гц, Н3(2)цис), 6,37 (уш. м 1Н, Н13NH амидный), 5,52 (д 1Н, 18,8 Гц) 5,25 (д 1Н, 19,2 Гц), СН215(1)), 4,42–4,52 (м 1Н, Н18), 4,35 (уш.д.,10 Гц, Н17), 3,26 (д 3Н, 5Гц, Н13(2)N-CH3 ), 3,83 (с 3Н, Н15(3)-CH3), 3,64 (с 3Н, Н17(4)-CH3), 3,55 (с 3Н, Н12(1)-CH3), 3,31 (с 3Н, Н7(1)-CH3), 3,73 (м 2Н, Н8(1)-СН2), 2,04–2,064 (м 4Н, Н17(1), 17(1»),17(2),17(2»)), 1,71 (м. 6Н, Н8(2)-СН3,18(1)-СН3), –1,69 (уш.с.1Н, I-NH ), –1,82 (уш.с. 1Н, III-NH). (7): 11.536 (с 1Н, Н7-СОН), 10,28 (с 1Н, Н10), 9,63 (с 1Н, Н5), 8,96 (с 1Н, Н20), 6,37 (уш. м. 1Н, Н13NH амидный), 5,55 (д 1Н, 18,8 Гц) ,23 (д 1Н, 18,8 Гц), СН215(1)), 4,42–4,52 (м 1Н, Н18), 4,38 (уш. д., 8,8 Гц, Н17), 3,27 (д. 3Н, 4,2Гц, Н13(2)N-CH3), 3,84 (с 3Н, Н15(3)-CH3), 3,79 (с 3Н, Н17(4)-CH3), 3,61 (с 3Н, Н12(1)СН3), 3,49 (с 3Н, Н2(1)-СН3), 3,32 (с 3Н, Н7(1)-CH3), 3,7–3,9 (м. 2Н, Н8(1)-СН2), 2,04–2,06 (м 4Н, Н17(1), 17(1»),17(2),17(2»)), 1,71 (м. 6Н, Н8(2)-СН3, 18(1)-СН3), – 1,69 (уш.с.1Н, I-NH ), – 1,99 (уш.с. 1Н, III-NH).
Окисление в системе этилацетат / вода. К раствору 32 мг метилфеофорбида а и 15 мг дибензо-18-краун-6 в 25 мл этилацетата прибавили раствор 100 мг перманганата калия в 15 мл воды. Смесь перемешивали при комнатной температуре в течение одного часа. За ходом реакции следили при помощи ТСХ (silufol, ССl4:ацетон = 3:1). Реакционную смесь промывали водой для удаления непрореагировавшего перманганата калия, затем эту смесь сушили над безводным сульфатом натрия и упаривали досуха. Масса продуктов окисления составила 13,3 мг.
К раствору 50 мг метилпирофеофорбида а и 16 мг дибензо-18-краун-6 в 55 мл этилацетата прибавили раствор 110 мг перманганата калия в 13 мл воды. Смесь перемешивали при комнатной температуре в течение 15 минут. За ходом реакции следили методом ТСХ (silufol, хлористый метилен: ацетон = 4:1). Реакционную смесь промывали водой для устранения перманганата калия, затем эту смесь сушили безводным Na2SO4 и наносили на колонку с силикагелем (колонку наполняли «мокрым способом» с хлористым метиленом), элюировали смесью хлористый метилен: ацетон в соотношении 10:1 (по объему). Выделено: 12 мг (23 %) диола (10) и 3 мг (6 %) альдегида (11).
Спектр ЯМР 1Н (CDCl3, 300 МГц), δ, м.д. (10) (смесь диастереомеров): 9,43/9,42 (c 1H, H10), 9,24 (с 1Н, H5), 8,47/8,46 (с 1Н, Н20), 6,10–5,98 (м, 1Н, Н3(1)), 5,09/5,08 (д 1H, 19,6 Гц, Н13(2)А), 4,98/4,97 (д 1H, 19,6 Гц, Н13(2)В), 4,43–4,34 (м 2H, Н17, Н18), 4,18–4,00 (м, 2Н, Н3(2)), CH3 (c 3H): 3,64/3,62 (с 3Н, Н17(4)), 3,49 (с 3Н, Н12(1)), 3,31/3,29 (с 3Н, Н2(1)), 3,12/3,11 (с 3Н, Н7(1)); СН2: 3,58–3,51 (м, 2Н, Н8(1)), 2,61–2,45 (м 2Н, Н17(1)), 2,33–2,06 (м 2Н, Н17(2)); СН3: 1,74/1,72 (д 3H, 8 Гц, Н18(1)), 1,61/1,60 (т 3Н, 7,2 Гц, Н8(2)), –2,14 (уш.с. 1Н, III – NH), ИК (см–1, KBr): 1748 (nC=O, сложный эфир), 1714 (nC=O, кето-группа в экзоцикле), 1674 (nC=О, альдегидная группа), 1624 («хлориновая полоса»). ЭСП (СНСl3, λ, нм): 663 (полоса I), 612, 552, 524, 415 (полоса Соре).
Спектр ЯМР 1Н (CDCl3, 300 МГц), δ, м.д. (11): 11,47 (с 1Н, Н3(1)), 10,22 (c 1H, H10), 9,51 (с 1Н, H5), 8,80 (с 1Н, Н20), 5,14 (д 1H, 18Гц, Н13(2)А), 5,01 (д 1H, 18Гц, Н13(2)В), 4,0–4,8 (м 1H, Н18), 4,0–4,8 (м 1H, Н17), CH3 (c 3H): 3,70 (с 3Н, Н12(1)), 3,58 (с 3Н, Н17(4)), 3,36 (с 3Н, Н2(1)), 3,25 (с 3Н, Н7(1)); СН2: 3,71–3,57 (м 2Н, Н8(1)), 2,1–2,8 (м 2Н, Н17(1)), 2,1–2,8 (м 2Н, Н17(2)); СН3: 1,84 (д 3H, 8 Гц, Н18(1)), 1,67 (т 3Н, 7,2 Гц, Н8(2)), –1,87 (уш.с. 1Н, III – NH), ИК (см–1, KBr): 2700 (nC–Н, альдегидная группа), 1748 (nC=O, сложный эфир), 1714 (nC=O, кето-группа в экзоцикле), 1674 (nC=О, альдегидная группа), 1624 («хлориновая полоса»). ЭСП (СНСl3, λ, нм): 696 (полоса I), 635, 552, 524, 430 (полоса Соре).
К раствору 149 мг 13(N)-метиламида-15,17-диметилового эфира хлорина е6 и 49 мг дибензо-18-краун-6 в 115 мл этилацетата прибавили раствор 203 мг перманганата калия в 20 мл воды. Смесь перемешивали при комнатной температуре в течение одного часа. За ходом реакции следили методом ТСХ (silufol, CCl4: ацетон = 4:1). Реакционную смесь промыли водой для устранения перманганата калия, затем эту смесь сушили безводным сульфатом натрия. Смесь разделяли колоночной хроматографией на силикагеле (элюэнт CCl4:ацетон в соотношении 15:1). Выделено 3 фракции: первая фракция, содержит смесь исходного метиламида и 3-формильного производного, во второй фракции находится 3-карбоксильное производное, а в третьей – диол. Первые две фракции исследовали при помощи ПМР-спектроскопии. Спектр ЯМР 1Н (CDCl3, 300 МГц), δ, м.д.: Фракция 1: сигналы совпадают с сигналами спектра ЯМР 1Н соединений (6) и (7). Фракция 2 (9): 10,198 (с 1Н, Н10), 9,631 (с 1Н, Н5), 8,891 (с 1Н, Н20), 6,489 (уш. м. 1Н, Н13NH амидный), 5,56 (д 1Н 20 Гц) 5,44 (д 1Н 20 Гц, СН215(1)), 4,48 (м 1Н, Н18), 4,37 (уш. д., 10,4 Гц, Н17), 3,86 (с 3Н, Н15(3)–CH3), 3,64 (с 3Н, Н17(4)–CH3), 3,56 (с 3Н, Н12(1)СН3), 3,23 (с 3Н, Н2(1)–СН3), 3,23 (с 3Н, Н7(1)–СН3), 2,65–2,11 (м 4Н, Н17(1), 17(1»),17(2),17(2»)), 1,69 (м 6Н, Н8(2)-СН3, 18(1)-СН3), – 1,50 (уш.с.1Н, I-NH ), –1,93 (уш.с. 1Н, III-NH).
Окисление диола. Исследуемое вещество (около 5 мг) растворили в 10 мл свежеперегнанного ТГФ и к полученному раствору прибавили раствор 120 мг периодата натрия в 0,75 мл воды и 0,05 мл уксусной кислоты. После 12-часового стояния полученную реакционную смесь разбавили хлороформом (150 мл) и хлороформенный раствор промывали насыщенным водным раствором NaHCO3 (3 раза по 50 мл) и водой (3 раза по 100 мл), сушили над безводным сульфатом натрия и анализировали при помощи ТСХ.
Результаты исследования и их обсуждение
Нами исследовано окисление ряда производных хлорофилла (см. табл. 1, 2) в условиях межфазного катализа в двухфазной водно-органической системе (органические растворители – бензол, хлороформ, этилацетат). В качестве межфазных катализаторов использовали дибензо-18-краун-6, поливиниловый спирт и хлорид триэтилбензиламмония (ТЭБАХ).
Вне зависимости от применявшихся растворителей и межфазных катализаторов окисление винильной группы протекало не селективно с образованием всех возможных продуктов (см. рис. 1).
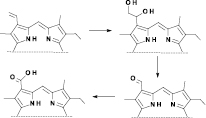
Рис. 1. Возможные продукты окисления винильной группы производных хлорофилла
Таблица 1
Субстраты для окисления перманганатом калия в условиях МФК и образовавшиеся вещества
|
R |
|
|
|
|
-СН=СН2 |
1 |
2 |
6 |
|
-СН=О |
3 |
11 |
7 |
|
-СН(ОН)-СН2ОН |
4 |
10 |
8 |
|
-СО2Н |
5 |
12 |
9 |
Реакцию окисления метилфеофорбида а (1) проводили при перемешивании раствора 1 и межфазного катализатора в бензоле с водным раствором перманганата калия при комнатной температуре. При перемешивании двухфазной системы происходит изменение цвета раствора и образование осадка – диоксида марганца. В результате реакции был получен метилфеофорбид d (3) с выходом 12 %, с чистотой не менее 90 % (по данным ЯМР). О прохождении реакции судили по данным ТСХ. Строение 3 было установлено методами электронной, ИК и ПМР-спектроскопии. В спектре ПМР продукта реакции по сравнению с исходным веществом исчезают сигналы винильной группы и появляется синглет протона альдегидной группы при 11,47 м.д. В спектре ПМР наблюдается сигнал атома водорода в положении 13(2). Это говорит о том, что окисление по экзоциклу не происходит.
В ИК-спектре полученного соединения по сравнению со спектром исходного вещества появляются полосы, соответствующие колебаниям связи С=О (1685 см –1) и С-Н альдегидной группы (2700 см-1). В электронном спектре полученного соединения полоса I смещается в красную область до 704 нм. Известно, что такие изменения в электронном спектре вызваны заменой винильной группы в положении 3 на альдегидную [1–3]. Дополнительная хроматографическая очистка вещества не понадобилась. В полученном бензольном растворе, по данным ТСХ, присутствует только 3 (основной продукт) и небольшое количество исходного 1. В спектре полученного соединения наблюдается сигнал примеси 1, содержание его составляет не более 10 % (по данным ЯМР). Продукты окисления винильной группы метилфеофорбида (а) до диольной (4) и карбоксильной (5) обнаружить не удалось. Отсутствие этих соединений в реакционной смеси можно объяснить селективностью окисления винильной группы 1 в этих условиях. Однако низкие выходы продуктов окисления, а также плохая воспроизводимость реакции свидетельствуют скорее о том, что диол и кислота в этой реакции образуются и отсутствие их в органической фазе обусловлено сорбцией этих соединений на диоксиде марганца с их последующим окислением.
Аналогичные результаты были получены при окислении метиламида (6). Выход окисленных производных в случае этого соединения был еще меньше. Исследование реакционной смеси при помощи ТСХ и ПМР-спектроскопии показывает, что основным ее компонентом является альдегид (7). О протекании реакции окисления винильной группы судили по уменьшению хроматографической подвижности продукта реакции по сравнению с исходным веществом. В спектре ПМР реакционной смеси отсутствуют сигналы винильной группы и появляется синглет протона альдегидной группы при 11,526 м.д. Масса реакционной смеси составляет 15,2 % от массы исходного соединения, причем, судя по ПМР-спектру, в реакционной смеси содержится значительное количество краун-эфира. Отсутствие в реакционной смеси продуктов окисления винильной группы метиламида до диольной (8) и карбоксильной (9) можно так же объяснить сорбцией этих соединений на диоксиде марганца с их последующим окислением. Полная сорбция этих соединений на диоксиде марганца, по-видимому, связана с их низкой растворимостью в бензоле. Если низкие выходы и отсутствие в реакционной смеси продуктов окисления до диола и кислоты связаны именно с окислительной сорбцией на диоксиде марганца, то при смене растворителя, во-первых, должен повыситься выход продуктов окисления и, во-вторых, должны появиться продукты окисления винильной группы метилфеофорбида а и метиламида до диольной и карбоксильной. В связи с этим в настоящей работе было изучено окисление перманганатом калия производных хлорофилла в двухфазной системе этилацетат / вода с использованием того же межфазного катализатора. Реакцию окисления метиламида проводили при перемешивании раствора метиламида в этилацетате с водным раствором перманганата калия при комнатной температуре. Выход продуктов окисления (масса реакционной смеси) составляет 20 % от массы исходного вещества. В реакционной смеси, по данным ТСХ, содержится непрореагировавший исходный метиламид и три продукта реакции. Из реакционной смеси при помощи колоночной хроматографии были выделены три фракции. На рис. 2 представлены области слабого поля спектров ПМР первой и второй фракций. Первая фракция, по данным ЯМР и ТСХ, представляет собой смесь исходного метиламида (6) и 3-формильного производного (7). В спектре ПМР этой фракции наблюдаются сигналы как исходного 6, так и 7. Основной компонент второй фракции представляет собой, по всей видимости, 3-карбоксильное производное (9). В спектре ПМР этой фракции для основного компонента отсутствуют как сигналы винильной, так и сигналы альдегидной групп. Это позволяет предположить, что в основном компоненте этой фракции винильная группа окислена до карбоксильной. Из сопоставления спектров ПМР этих фракций видно, что все три продукта окисления содержатся в различных соотношениях в обеих фракциях.
Основным компонентом реакционной смеси является диол (8), составляющий третью фракцию. Строение диола было подтверждено химическими превращениями. Окисление исследуемого соединения периодатом натрия в смеси уксусной кислоты и воды дает 7. Образование альдегида подтверждает предположение о том, что исходное соединение было виц-диолом, так как для этих соединений характерна такая реакция. Аналогичные результаты были получены при окислении 1. Таким образом, в результате окисления 1 и 6 в системе этилацетат / вода выход окисленных продуктов в 2 раза больше, чем в системе бензол / вода, причем в реакционной смеси появляются диольные и карбоксильные производные. Эти данные свидетельствуют в пользу предположения об окислительной сорбции этих соединений из бензола при проведении окисления в системе бензол / вода. При окислении в тех же условиях более устойчивого метилпирофеофорбида а (2) выход окисленных производных получается несколько больше, чем в предыдущих случаях. Реакцию окисления 2 проводили при перемешивании раствора 2 и межфазного катализатора в этилацетате с водным раствором перманганата калия при комнатной температуре. Реакция прошла сразу после добавления раствора KМnO4.
Фракция 1.
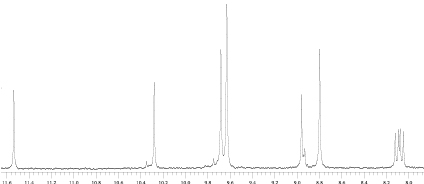
Фракция 2.
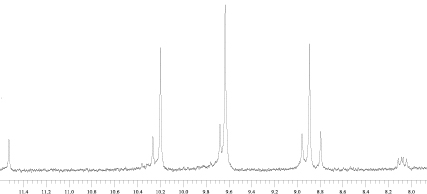
Рис. 2. Спектры ПМР фракций 1 и 2 области слабого поля
Таблица 2
Окисление производных хлорофилла перманганатом калия в условиях МФК
|
Соединение |
Межфазный катализатор |
Система |
Продукты |
Выход, % |
|
Метилфеофорбид а |
Дибензо-18-краун-6 |
Бензол/вода |
Альдегид |
12 |
|
Метилфеофорбид а |
Дибензо-18-краун-6 |
Хлористый метилен/вода |
Диол, альдегид, карбоновая кислота |
6 |
|
Метилфеофорбид а |
ТЭБАХ |
Бензол/вода |
Диол, альдегид, карбоновая кислота |
2 |
|
Метилфеофорбид а |
ТЭБАХ |
Этилацетат/вода |
Диол, альдегид, карбоновая кислота |
2 |
|
Метилфеофорбид а |
ПВС |
Бензол/вода |
Окисление не происходит |
|
|
13(2)-гидроксиметилфеофорбид а |
Дибензо-18-краун-6 |
Хлористый метилен/вода |
Диол, альдегид, карбоновая кислота |
7 |
|
13(2)-гидроксиметилфеофорбид а |
Дибензо-18-краун-6 |
Ацетон |
Диол, альдегид, карбоновая кислота |
15 |
|
13(2)-гидроксиметилфеофорбид а |
ПВС |
Бензол/вода |
Окисление не происходит |
|
|
Метилпирофеофорбид а |
Дибензо-18-краун-6 |
Ацетон |
Диол, альдегид, карбоновая кислота |
10 |
Основным продуктом реакции являлся 3-(1,2-дигидроксиэтил)-3-дезвинил-метил-пирофеофорбид а (10), выход по массе 12 мг (23 %). Метилпирофеофорбид d (11) образовался в незначительных количествах, выход по массе 3 мг (6 %). По-видимому, более низкие выходы реакций окисления 6 и 1 по сравнению с выходом продуктов окисления метилпирофеофорбида а наблюдаются из-за протекающих побочных реакций, связанных с относительно большой реакционной способностью метиленовой группы в положении 15 (6) и метиновой группы в положении 13(2) соединения 1. Однако высоких выходов при окислении в этой системе не удается достигнуть даже в случае относительно стабильных производных хлорофилла.
Эти данные свидетельствуют о том, что в сорбции на диоксиде марганца задействованы не только реакционно-способные периферические заместители, но и сам порфириновый цикл, скорее всего NH-атомы пиррольных колец. Вместе с тем наличие в порфириновом цикле реакционно-способных заместителей способствует протеканию побочных реакций на поверхности диоксида марганца.
Заключение
Таким образом, окисление исследуемых производных хлорофилла с использованием межфазных катализаторов (см. табл. 2) идет не селективно и с низким выходом порфириновых соединений. Низкий выход окисленных производных во всех случаях связан, возможно, с сорбцией порфиринов на диоксиде марганца с последующим их окислением. При использовании ПВС окисления не происходит. Полученные результаты неприемлемы для последующего применения в препаративных целях.
Библиографическая ссылка
Тулаева Л.А., Забалуева О.А., Белых Д.В. ОКИСЛЕНИЕ ПРОИЗВОДНЫХ ХЛОРОФИЛЛА ПЕРМАНГАНАТОМ КАЛИЯ В УСЛОВИЯХ МЕЖФАЗНОГО КАТАЛИЗА // Успехи современного естествознания. 2018. № 2. С. 23-29;URL: https://natural-sciences.ru/ru/article/view?id=36667 (дата обращения: 22.12.2025).