Инозитгексафосфорная (ИГФК, фитиновая) кислота является продуктом растительного происхождения, но ее состав и структура могут различаться в зависимости от сырья и способа его переработки [1]. В научной литературе описаны комплексы ИГФК с различными металлами (Zn, Cu, Co, Mn, Cd, Pb, Hg, Ni, Sn, Fe) [2].
Способность ИГФК и её солей эффективно хелатировать катионы металлов позволяет рассматривать их в качестве сорбента ионов тяжелых металлов из водных растворов.
В Институте химии ДВО РАН проведены исследования по кинетике сорбции ионов тяжелых металлов (Co2+, Sr2+, Pb2+, Cd2+, Zn2+, Ni2+, Cu2+ и Mn2+) сорбентом на основе производного ИГФК (далее – фитиновым сорбентом), полученного из отходов производства риса, представляющих собой рисовую мучку [3–5].
Цель исследования – изучение процесса извлечения ионов Co2+ вышеуказанным фитиновым сорбентом.
Материалы и методы исследования
В качестве исходного сырья использовали рисовую мучку, размер частиц которой составлял 0,3 мм. Данная рисовая мучка была получена при шлифовке зерна риса, выращенного в пос. Тимирязевский (Приморский край).
Для получения сорбента на основе производного фитиновой кислоты рисовую мучку подвергали кислотному гидролизу 0,27 М соляной кислотой, раствор направляли на ультрафильтрацию. Из очищенного экстракта производное ИГФК осаждали 2,75 М гидроксидом натрия.
Опыты по сорбции проводили в статических условиях при соотношении твердой и жидкой фаз, равном 1:400 и температуре 20 °С из водных растворов хлорида кобальта с различными начальными концентрациями ионов Co2+ в диапазоне от 0,4 до 9,7 ммоль·л-1 при перемешивании на магнитной мешалке в течение 3 ч. Растворы хлорида кобальта заданной концентрации готовили растворением точных навесок CoCl2·6H2O квалификации «ч.д.а.» (ГОСТ 4525-77) в дистиллированной воде. В качестве контрольного опыта навеску сорбента помещали в пробирку с дистиллированной водой и перемешивали параллельно с исследуемыми пробами. Затем растворы отделяли от сорбента фильтрованием (бумажный фильтр «синяя лента») и определяли в нем текущую концентрацию ионов Co2+.
Для оценки кинетики сорбции ионов Co2+ в серию пробирок помещали навески сорбента, заливали их водным раствором хлорида кобальта с начальной концентрацией ионов Co2+ 3,8 ммоль·л-1 и перемешивали при 20, 40 и 60 °С и различных временных интервалах – от 1 до 180 мин. Через определенные промежутки времени раствор отделяли от сорбента фильтрованием и устанавливали в нем концентрацию ионов Co2+.
Сорбционную емкость (Ас, ммоль·г-1) фитинового сорбента рассчитывали по формуле
Ac = (Cисх – Ср)V/m, (1)
где Сисх – исходная концентрация иона металла в растворе, ммоль·л-1; Ср – равновесная концентрация иона металла в растворе, ммоль·л-1; V – объем раствора, л; m – масса сорбента, г.
Степень извлечения ионов металлов (α, %) рассчитывали по формуле
α = [(Cисх – Ср)/Cисх]•100 %. (2)
Коэффициент межфазного распределения (Kd, мл/г) определяли следующим образом:
Kd = [(Cисх – Ср)/Cисх]V/m, (3)
где V – объем исследуемого раствора, мл; m – масса сорбента, г.
Рентгенограммы веществ снимали на рентгеновском дифрактометре Bruker D8 ADVANCE (Германия) в Cu Kα-излучении; идентификация полученных рентгенограмм выполнена по программе EVA с банком порошковых данных PDF-2.
Для количественного определения элементного состава образцов применяли энергодисперсионный рентгенофлуоресцентный метод с использованием спектрометра Shimadzu EDX 800 HS (Япония). Анализ проводили без учета легких элементов. Концентрацию определяемых элементов рассчитывали по методу фундаментальных параметров с использованием программного обеспечения спектрометра. Относительная погрешность определения не превышала ±2 %.
ИК-спектры поглощения фосфорсодержащих образцов регистрировали в области 400–4000 см-1 в вазелиновом масле с использованием Фурье-спектрометра Shimadzu FTIR Prestige-21 (Япония) при комнатной температуре.
Удельную поверхность образцов определяли методом низкотемпературной адсорбции азота с использованием прибора «Сорбтометр-М» (Россия).
Содержание ионов Co2+ в растворах определяли методом атомно-абсорбционной спектрометрии на двулучевом спектрометре SOLAAR M6 (Thermo, США) по аналитической линии 240,7 нм.
По данным рентгенофазового анализа, фосфорсодержащее соединение, полученное из рисовой мучки, является рентгеноаморфным.
ИК-спектр выделенного продукта характеризуется наличием широких интенсивных полос поглощения в области 1127, 997 и 539 см-1, которые относятся к валентным (симметричным и асимметричным) и деформационным колебаниям связей Р–О в анионе РО43- [6]. О наличии групп ОН свидетельствуют полосы поглощения в ИК-спектре в области валентных (3392 см-1) и деформационных (1660 см-1) колебаний. ИК-спектр фосфорсодержащего образца сопоставим с ИК-спектром коммерческого фитина [1].
Результаты исследования и их обсуждение
Количественное определение элементного состава показало, что соотношение элементов в выделенном фосфорсодержащем продукте из рисовой мучки: Р:С = 5,3–5,1:6, что свидетельствует о присутствии в изучаемых веществах фрагментов С6P5, входящих в состав пентофосфоинозитида.
Удельная поверхность полученного образца составляет 10,8 м2·г-1.
На основании полученных экспериментальных данных по сорбции ионов Co2+ исследуемым сорбентом построена изотерма сорбции (рис. 1).
Для оценки сорбционных свойств полученную изотерму анализировали в соответствующих координатах уравнения Ленгмюра и эмпирического уравнения Фрейндлиха.
Уравнение Ленгмюра:
Cp/Ac = (1/Amaxk) + Сp/Amax, (4)
где Ср – равновесная концентрация ионов Co2+ в растворе, Amax – максимальная сорбционная емкость, k – константа Ленгмюра.
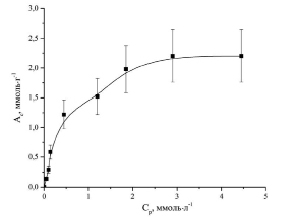
Рис. 1. Изотерма сорбции ионов Co2+ фитиновым сорбентом (Ас – сорбционная емкость, Ср – равновесная концентрация ионов Co2+ в растворе)
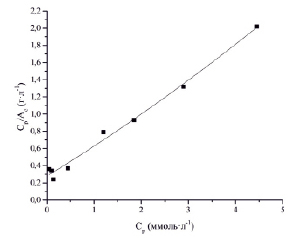
Рис. 2. Изотерма сорбции ионов Co2+ фитиновым сорбентом в координатах линейного уравнения Ленгмюра
Константы уравнения были рассчитаны из наклона и пересечения прямых на графике в соответствующих координатах линейного уравнения Ср/Ас от Ср (рис. 2).
Логарифмическую форму уравнения Фрейндлиха применяли для построения линейной зависимости и ln Ac – ln Cр и графического определения параметров KF и n:
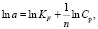 (5)
(5)
где KF – константа равновесия уравнения Фрейндлиха, относящаяся к сорбционной емкости; 1/n – параметр, указывающий на интенсивность взаимодействия сорбент – сорбат.
Параметры уравнений Ленгмюра и Фрейндлиха для сорбции ионов Co2+ фитиновым сорбентом
|
Уравнение Ленгмюра |
Уравнение изотермы Фрейндлиха |
||||
|
Am, ммоль·г-1 |
k, л·ммоль-1 |
R2 |
KF, (ммоль/г)•(л/ммоль)1/n |
1/n |
R2 |
|
2,6 |
1,49 |
0,989 |
1,274 |
0,5884 |
0,9115 |
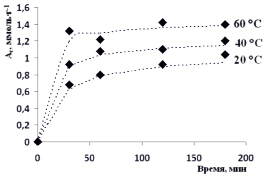
Рис. 3. Кинетические кривые сорбции ионов Co2+ фитиновым сорбентом при различных температурах
Найденные графическим способом параметры уравнений Ленгмюра и Фрейндлиха представлены в таблице.
Из представленной таблицы видно, что для описания сорбции ионов Co2+ фитиновым сорбентом подходит как модель Ленгмюра, так и модель Фрейндлиха, о чем свидетельствуют соответствующие коэффициенты корреляции.
На рис. 3 приведены кинетические кривые сорбции ионов Co2+ фитиновым сорбентом при температурах 20, 40 и 60 °С.
Как видно из представленного рис. 3, при различных температурах наблюдаются изменения в кинетике извлечения ионов Co2+ . С повышением температуры от 20 до 60 °С сорбционная емкость исследуемого сорбента увеличивается до 1,4 ммоль·г-1 (степень извлечения ионов Co2+ составляет 92,1 %).
Данные по кинетике сорбции, представленные на рис. 3 в виде пунктирных линий, представляют собой предложенные эмпирические зависимости, построенные в соответствии с уравнением, формально напоминающем уравнение Ленгмюра:
At = Am·k·t·1/1 + k·t, (6)
где Am – максимальная сорбционная емкость при данной температуре, ммоль·г-1; k – постоянная, имеющая размерность мин-1, равна обратной величине времени сорбции, при котором сорбционная емкость достигает половины максимального значения (определена из экспериментальных данных для каждой температуры). Экспериментальные точки значений сорбционной емкости отличаются от эмпирических зависимостей не более чем на 14 %, что соответствует погрешности определения концентрации ионов кобальта.
Установлено, что наибольшие значения коэффициента распределения Kd Co2+ наблюдаются при соотношении твердой и жидкой фаз, равном 1:100 (5800 мл/г).
Таким образом, из представленных экспериментальных данных следует, что сорбент на основе инозитгексафосфорной кислоты, полученный из отходов производства риса, может быть использован в качестве сорбента при очистке водных растворов от ионов кобальта в статических условиях.
Выводы
Исследован процесс извлечения ионов Co2+ в статических условиях при соотношении твердой и жидкой фаз, равном 1:400, и температуре 20 °С из водных растворов хлорида кобальта сорбентом на основе производного инозитгексафосфорной (фитиновой) кислоты, полученным из отходов производства риса. Показано, что для описания сорбции ионов Co2+ фитиновым сорбентом подходит как модель Ленгмюра, так и модель Фрейндлиха, о чем свидетельствуют соответствующие коэффициенты корреляции. Установлено, что максимальная сорбционная емкость исследуемого сорбента составляет 2,6 ммоль·г-1. Показано, что при повышении температуры от 20 до 60 °С сорбционная емкость фитинового сорбента увеличивается во всем временном интервале, достигая через 180 мин значений 1,4 ммоль·г-1. Установлено, что наибольшие значения коэффициента распределения Kd Co2+ наблюдаются при соотношении твердой и жидкой фаз, равном 1:100 (5800 мл/г). Полученные данные могут быть использованы для выбора оптимальных параметров процесса извлечения ионов тяжелых металлов с применением сорбента на основе производного фитиновой кислоты, а также материалов на его основе.
Работа выполнена при поддержке гранта Президента РФ для государственной поддержки молодых российских ученых – кандидатов наук МК-2884.2017.3 и проекта 4.5913.2017/8.9 в рамках базовой части государственного задания образовательных организаций высшего образования, находящихся в ведении Министерства образования и науки Российской Федерации.
Библиографическая ссылка
Ярусова С.Б., Макаренко Н.В., Гордиенко П.С., Азарова Ю.А., Новикова Е.С. ИЗВЛЕЧЕНИЕ ИОНОВ CO2+ СОРБЕНТОМ НА ОСНОВЕ ПРОИЗВОДНОГО ИНОЗИТГЕКСАФОСФОРНОЙ КИСЛОТЫ // Успехи современного естествознания. 2018. № 2. С. 30-34;URL: https://natural-sciences.ru/ru/article/view?id=36668 (дата обращения: 14.02.2026).
DOI: https://doi.org/10.17513/use.36668



