В литературе имеются данные по действию гемина на опухолевые клетки. Так, в работе румынских авторов [1] обнаружено, что гемин в концентрациях 10–100 мкМ тормозил пролиферацию клеток гепатом. В исследованиях российских авторов [2] обнаружена антимикробная, вирулицидная и антибактериальгая активность производных гемина на клеточных культурах. Полученный эффект авторы связывают с окислительными свойствами гемина. Нами [3] на модельной системе было установлено, что гемин в концентрациях 50–100 мкМ в 2 и 4 раза соответственно (дозозависимый эффект) ускоряет окисление лимонена, т.е. обладает окислительной активностью. По-видимому, цитотоксическое действие гемина на опухолевые клетки in vitro обусловлено его окислительными свойствами. Представляло интерес изучить действие гемина на опухоль in vivo (на животных).
Цель исследования: разработка методов получения магнитоуправляемых препаратов гемина на основе микрочастиц феррокомпозитов разного химического состава, изучение десорбции гемина из препаратов в модельной биологической жидкости и оценка противоопухолевой активности препаратов на карциному Льюис у мышей.
Материалы и методы исследования
Необходимость использования носителей для создания лекарственной формы гемина связана с нерастворимостью гемина в водных растворах при физиологических значениях рН 7,0–7,4. Магнитоуправляемые препараты гемина были получены на основе микрочастиц феррокомпозитов с немодифицированной и модифицированной белками (альбумин, желатин) и полисахаридами (декстран) поверхностью. Модификация поверхности частиц проводилась по ранее отработанной нами методике [4]. Были использованы микрочастицы феррокомпозитов: железо-углерод (FeC) с различным содержанием железа и углерода с размером частиц 0,2–2 мкм, полученные методом низкотемпературного пиролиза [5], а также порошок металлического железа с размером частиц 0,6 мкм.
Подготовка феррокомпозитов для иммобилизации гемина
Поскольку частицы композитов в растворе агрегируют, для получения однородной по размерам суспензии проводили ультразвуковое диспергирование суспензии на ультразвуковом диспергаторе УЗДН-Т при частоте излучения 22 кГц, силе тока 50 мА в течение 5–10 минут при температуре 3–5 °С. Для хранения использовали композиты в виде суспензии концентрацией 50–10 мг/мл в 0,85 % NaCI (рН 7,4).
Модификация поверхности композитов альбумином, желатином и декстраном
Для покрытия композитов альбумином и желатином использовали 0,1 % растворы человечьего альбумина и желатина (фирмы Fluca) в 0,85 % NaCI (рН 7,4). Суспензии композитов 10 мг/мл и белков озвучивали на УЗДН-Т при 22 кГц в течение 2 мин и инкубировали при температуре 20 °С 90 мин при перемешивании, осаждали на Sm-Co магните индукцией 0,15 Tl. Осадок ресуспендировали в 0,85 % NaCI. К суспензии покрытых белками композитов добавляли раствор формальдегида, инкубировали в течение 15 мин и отмывали дистиллированной водой от избытка формальдегида. Полученный осадок ресуспендировали в 0,85 % NaCI. Для покрытия частиц декстраном использовали 0,1 % декстран (Mm 40 тыс. Da, фирма SIGMA) в 0,85 % NaCI. Инкубацию проводили в течение 1 ч, осаждали на Sm-Co магните и отмывали от избытка декстрана.
Получение магнитоуправляемых препаратов гемина
Иммобилизация гемина (фирма Fluca) проводилась из щелочных растворов при весовых соотношениях композит/гемин: 10/1, 5/1 и 2/1 путем инкубации гемина в концентрации и 1 мг/мл в 0,05 N NaOH (рН 11,5) и суспензии композитов 10 мг/мл в NaCI в течение 60–90 минут при комнатной температуре (20–22 °С). Затем частицы с гемином осаждали на Sm-Co магните и в супернатанте определяли количество гемина. Расчет концентрации гемина проводился по калибровочной прямой путем определения оптической плотности супернатанта при 390 нм. Опыты повторяли не менее 5-и раз, для каждого опыта рассчитывали среднее значение и средне-квадратичное отклонение. Осадки использовали для десорбции в модельной биологической жидкости: раствор 0,6 % альбумина в 0,85 % NaCI (рН 7,4).
Динамика десорбции гемина из магнитоуправляемых препаратов
К осадкам композитов с иммобилизованным гемином приливали по 2 мл 0,6 % альбумина в 0,85 % NaCI (рН 7,4) и проводили десорбцию при 37 °С в течение 7 ч c периодическим осаждением суспензии частиц, сливом супернатанта для взятия проб на определение концентрации десорбированного гемина и добавлением новой порции 0,6 % альбумина к осадкам. Расчет концентрации десорбированного гемина проводился по калибровочной прямой путем определения оптической плотности супернатанта при 390 нм. Опыты повторяли не менее пяти раз, для каждого опыта рассчитывали среднее значение и средне-квадратичное отклонение.
Оценка действия препаратов гемина на карциному Льюис у мышей
Опыты проводились на мышах (самцах) линии F1(C57xDBА) весом 20–22 г. Суспензию опухолевых клеток карциномы Льюис в концентрации 14,5 х 106 клеток в 1 мл вводили мышам внутримышечно (в бедро правой лапы) по 0,2 мл в физиологическом растворе. Животные делились на группы (по 7 мышей в каждой группе): 1 – контроль (развитие опухоли без воздействия). Группы 2, 3 и 4 – опытные. Мышам 1 и 2 групп интратуморально вводили по 0,2 мл физиологического раствора и 0,2 мл суспензии микрочастиц FeC концентрацией 10 мг/мл в физиологическом растворе соответственно. Мышам 3, 4 групп – суспензию препарата гемина, иммобилизованнованного на микрочастицах FeC концентрацией 50 мкМ и 100 мкМ (с учетом значений суммарной концентрации гемина после 6-часовой десорбции) соответственно. После введения суспензии магнитных частиц к мышам 2, 3 и 4 групп к опухоли на 5 мин прикладывали Sm-Co магниты индукцией 0,15Tl. В предварительных опытах нами было показано, что однократное приложение магнита к опухоли после интратуморального введения суспензии магнитных частиц на 3–5 мин позволяет создать депо частиц в области опухоли не менее, чем на 1 сутки. Через 12 суток после трансплатации в опытных и контрольной группах определяли объем внутримышечной опухоли на основе трёх взаимно перпендикулярных измерений размеров опухоли и на протяжение последующих двух недель число погибших животных.
Результаты исследования и их обсуждение
Было определено оптимальное время инкубации гемина с композитами для достижения максимальной сорбционной емкости по гемину, которое составило ≥ 90 мин. Результаты сорбционной эффективности ( % адсорбции и сорбционная емкость) железо-углеродного композита и микрочастиц Fe по гемину представлены в табл. 1 и 2.
Таблица 1
Сорбционная эффективность к гемину FeC-композита марки 290/4-F (Fe-56 %, C-44 %)
|
Сорбционная эффективность |
Весовое отношение композит/ гемин |
Модификация поверхности композита |
|||
|
не модиф. |
модиф. жел. |
модиф.ж. + форм-альд. |
модиф. декстра-ном |
||
|
Сорбция, % (М ± m) |
10/1 |
78,4 ± 8,4 |
75 ± 7,7 |
69,4 ± 6,8 |
59 ± 5,7 |
|
2/1 |
25,4 ± 1,8 |
23,4 ± 1,4 |
16,8 ± 1,2 |
19,4 ± 1,9 |
|
|
Сорбционная емкость, мг/г (M ± m) |
10/1 |
78,4 ± 8,4 |
75 ± 7,7 |
69,4 ± 6,8 |
59 ± 5,7 |
|
2/1 |
127,0 ± 9,0 |
117,0 ± 7,0 |
84,0 ± 6,0 |
97,0 ± 9,5 |
|
Таблица 2
Сорбционная эффективность к гемину микрочастиц железа
|
Сорбционная эффективность |
Весовое отношение Fe / гемин |
Модификация поверхности микрочастиц |
|||
|
Fe, не модиф. |
Fe, модиф.альб. |
Fe, модиф.альб. + формальд. |
Fe, модиф декстр. |
||
|
Сорбция, % (М ± m) |
10/1 |
27,8 ± 2,2 |
34,1 ± 2,3 |
58,6 ± 6,9 |
44,7 ± 5,0 |
|
2/1 |
21,9 ± 1,7 |
27,5 ± 1,9 |
33,6 ± 2,1 |
12,3 ± 1,1 |
|
|
Сорбционная емкость, мг/г (M ± m) |
10/1 |
27,8 ± 2,2 |
34,1 ± 2,3 |
58,6 ± 6,9 |
44,7 ± 5,0 |
|
2/1 |
109,4 ± 8,5 |
137,5 ± 9,5 |
168,0 ± 11,5 |
61,5 ± 5,5 |
|
Из данных табл. 1 видно, что модификация поверхности FeC-композитов желатином и желатином с формальдегидом, а также с декстраном приводит к снижению сорбционной эффективности по гемину, т.е. физическая адсорбция гемина (в поры сорбента) является более эффективной, чем иммобилизация путем коньюгации желатина и декстрана с гемином. Сорбционная эффективность микрочастиц Fe к гемину возрастает после модификации их поверхности альбумином (табл. 2), так как преобладающую роль в данном случае, по-видимому, играет образование коньюгатов между ионогенными группами альбумина и гемина, что подтверждается характером спектров взаимодействия гемина с альбумином (рис. 1).
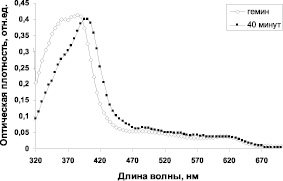
Рис. 1. Спектры поглощения гемина после инкубации с альбумином (среда: 0,85 % NaCI + 0,05 N NaOH, pH 8,5 Т 37 °С). Концентрации в кювете: гемин – 0,01 мг/мл, альбумин – 2мг/мл
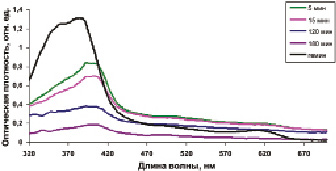
Рис. 2. Спектры поглощения гемина после десорбции из микрочастиц железа, покрытых желатином. Концентрация гемина в кювете 0,018 мг/мл (среда: 0,6 % альбумин в 0,85 % NaCI, рН 7,4)
При взаимодействии гемина с альбумином (рис. 1) наблюдается сдвиг максимума поглощения продукта реакции в длинноволновую область (пик в области 400 нм), что подтверждает наше предположение об образовании конъюгатов гемина с альбумином (желатином) при иммобилизации гемина на микрочастицах железа, покрытых белками и соответствует данным работы [6], в которой обнаружено образование коньюгатов гемина с альбумином и показано, что реакция носит обратимый характер. Аналогичный характер спектральных характеристик гемина обнаружен и при взаимодействии гемина с желатином. Очевидно, образование коньюгатов гемина происходит за счет взаимодействия между пропионовокислыми группами гемина и аминогруппами белков.
На рис. 2 представлены спектры поглощения гемина после десорбции из микрочастиц железа, покрытых желатином.
При десорбции гемина, иммобилизованного на микрочастицах железа, покрытых желатином (рис. 2), отмечается сдвиг максимума поглощения продукта реакции в длинноволновую область (пик в области 400 нм), что свидетельствует об образовании конъюгатов гемина с альбумином. Очевидно, имеет место переход гемина из коньюгатов с желатином, покрывающих поверхность микрочастиц, в раствор с образованием коньюгатов с альбумином. Характер динамики десорбции гемина из композитов с немодифицированной и модифицированной поверхностью одинаков: через 5–15 мин инкубации скорости десорбции замедляются. Так, скорость десорбции гемина из препаратов FeC с немодифицированной поверхностью идет наиболее эффективно в первые 5 мин инкубации, из препаратов Fe и FeC с модифицированной белками поверхностью в первые 10–15 мин инкубации (рис. 2). Кривая суммарной десорбции выходит на плато через 5–6 ч для всех типов сорбентов.
В табл. 3 представлены результаты по показателям адсорбции и суммарной десорбции гемина, иммобилизованного на микрочастицах феррокомпозитов, при различных способах модификации поверхности через 6 ч инкубации (суммарная десорбция) в модельном биологическом растворе.
Таблица 3
Показатели адсорбции и суммарной десорбции гемина из магнитоуправляемых препаратов через 6 ч инкубации в модельном биологическом растворе (0,6 % альбумин в 0,85 % NaCI, рН 7,4)
|
Сорбционная эффективность |
Типы сорбентов |
|||||
|
FеС |
FeC + альб. |
FeC + жел. |
Fe + жел. |
Fe + жел. + формальд. |
Fe + декст. |
|
|
Сорбц. емкость мг/г |
127,0 ± 9,1 |
119,7 ± 8,1 |
117,1 ± 8,7 |
137,5 ± 9,5 |
168,0 ± 11,3 |
66,5 ± 5,5 |
|
Десорб. % |
79,4 ± 7,1 |
41,6 ± 3,9 |
58,3 ± 4,7 |
74,8 ± 6,7 |
4,2 ± 0,8 |
3,0 ± 0,6 |
Как видно из таблицы, величина суммарной десорбции зависит от типа сорбента и модификации поверхности. Так, в случае десорбции гемина, иммобилизованного на железо-углеродном композите, значение десорбции составляет 79,4 %, для композита, покрытого альбумином, соответствующее значение составляет 41,6 %. Десорбция из препаратов на основе микрочастиц железа, модифицированных желатином с формальдегидом и декстраном, практически не идет, что может быть обусловлено образованием устойчивых коньюгатов гемина, разрыв которых энергетически затруднен. Исходя из данных табл. 3, для интратуморального введения мышам был выбран препарат гемина, полученный иммобилизацией на железо-углеродном композите с немодифицированной поверхностью, имеющий высокие значения сорбционной емкости 127,0 мг/г и десорбции 79,4 %.
Результаты оценки противоопухолевой активности магнитоуправляемого препарата гемина на карциноме Льюис у мышей
Обнаружено, что через 12 суток после трансплантации у мышей опытных групп (3 и 4) после интратуморального введения препарата гемина на основе комопзита FeC концентрацией 50 мкМ и 100 мкМ (с учетом значений суммарной десорбции) объемы опухоли уменьшились на 5,0 % и 10,0 % соответственно, по сравнению с контрольными группами (1 и 2). Выживаемость мышей в группе 4 (при концентрации гемина 100 мкМ) по сравнению с группами 1, 2 и 3 увеличилась на 2 суток.
Заключение
Результаты оценки противоопухолевой активности препаратов гемина, полученных на основе микрочастиц феррокомпозитов, на карциноме Льюис у мышей свидетельствуют о перспективности проведения дальнейших исследований противоопухолевого действия препаратов гемина, иммобилизованного на магнитных носителях. Использование синтезированных нами наночастиц магнетита [7] в качестве основы для создания магнитоуправляемых препаратов гемина позволит осуществить внутривенное введение препарата и создать его депо в клетках опухоли, вследствие чего можно ожидать значительную противоопухолевую активность препаратов гемина по сравнению с препаратами на основе микрочастиц магнетита.
Библиографическая ссылка
Комиссарова Л.Х., Марнаутов Н.А., Голощапов А.Н., Кузнецов А.А., Ерохин В.Н., Семенов В.А., Никольская Т.А., Грин М.А., Митиани Л.Ш. МАГНИТОУПРАВЛЯЕМЫЕ ПРЕПАРАТЫ ГЕМИНА НА ОСНОВЕ МИКРОЧАСТИЦ ФЕРРОКОМПОЗИТОВ И ОЦЕНКА ИХ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТИ // Успехи современного естествознания. 2018. № 10. С. 17-21;URL: https://natural-sciences.ru/ru/article/view?id=36875 (дата обращения: 03.01.2026).



