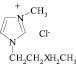
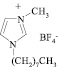
В последнее время соединения под названием «ионные жидкости» вызывают большой интерес у ученых в самых различных областях науки. Прежде всего это связано с тем, что ионные жидкости относят к числу «зеленых» реагентов. Многочисленные исследования посвящены поиску решений экономических и экологических проблем, существующих в мире в настоящее время. Это, прежде всего, загрязнение окружающей среды и нерациональное использование природных ресурсов.
Ионные жидкости представляют собой огромный класс веществ, имеющих в своем составе определенные ионы. Эти соединения впервые были получены в 1914 г. Первая ионная жидкость имела температуру плавления 12 °С и получена была русским ученым П. Вальденом. В первой публикации об ионных жидкостях, которая вышла в 1888 г., говорилось о синтезе нитрата этаноламмония с температурой плавления 52–55 °С. В период с 1940 по 1980 г. было получено большое число самых разнообразных ионных жидкостей. Сейчас они представляют огромный интерес для ученых и в различных источниках информации описывается свыше 500 ионных жидкостей [1].
Ионные жидкости – низкотемпературные (tпл < 100 °С) расплавы солей, используемые в качестве электролитов в электрохимических процессах или среды в химических процессах и процессах разделения. Чаще всего применяют расплавы на основе органических солей. Содержат органические катионы, например диалкилимидазолиевые, алкилпиридиниевые, алкиламмониевые, алкилфосфониевые, и неорганические (Br-, BF-4, PF-6 и др.) либо органические (CF3COO-, CF3SO-3 и др.) анионы. Впервые были исследованы П. Вальденом в 1914 г. на примере жидкой при комнатной температуре комплексной соли [С2Н5NH3]+[NO3]. Термин «ионные жидкости» появился в начале 1980-х гг., систематические исследования ионных жидкостей проводятся с 1990-х гг. [2].
Ионные жидкости нелетучи, малотоксичны, негорючи, устойчивы по отношению к высоким температурам и различным химическим веществам, в широком интервале температур остаются в жидком состоянии, являются отличными растворителями для различных химических соединений, в том числе комплексных и полимерных материалов. Ионные жидкости имеют разнообразные структуры (что позволяет варьировать в широких пределах свойства ионных жидкостей, например кислотно-основные или вязкость), пригодны для многократного использования, имеют хорошую ионную проводимость (более 10-4 Ом-1·см-1), большим напряжением разложения (более 4 В) [2].
Наиболее распространённые ионные жидкости получают N-алкилированием гетероциклических соединений галогеналканами с последующим анионным обменом. Представляет интерес применение ионных жидкостей в роли катализаторов и реакционных сред при получении органических, металлорганических и полимерных соединений, электролитов в электрохимии, гальванических элементов в процессах электроосаждения металлов и сплавов, продуктивных и безвредных для окружающей среды растворителей и экстрагентов, в частности катионов металлов [2].
Большой интерес представляет использование ионных жидкостей в органическом синтезе. Нами изучено взаимодействие халконов (1, 2) с этилацетоацетатом и ацетатом аммония в присутствии 10–30 мол. % хлорида 1-н-бутил-3-метилимидазолия и тетрафторбората 1-н-октил-3-метилимидазолия. Процесс осуществляли кипячением реагентов в абсолютном этаноле [3].
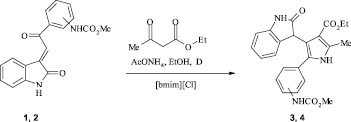
Найдено, что наименьшая продолжительность процесса (3 ч) и наибольшие выходы 3-пиррол-3'-илоксоиндолов (3, 4) наблюдаются при использовании 20 мол. % хлорида 1-н-бутил-3-метилимидазолия. Применение тетрафторбората 1-н-октил-3-метилимидазолия в этих превращениях также приводит к получению пирролоиндолов (3, 4) с высокими выходами (88, 90 % соответственно), однако продолжительность процесса при этом возрастает до 4 ч. Повышение концентрации ионной жидкости до 30 мол. % не приводит к увеличению выхода продуктов и сокращению продолжительности реакций (табл. 1) [3].
Таблица 1
Выходы 3-пиррол-3'-илоксоиндолов (3, 4) и продолжительность процесса в зависимости от типа и мольной доли ионной жидкости
|
Ионная жидкость |
Концентрация, мол. % |
Продолжительность процесса, ч |
Выход, % (№ соед.) |
|
|
10 |
6 |
62 (3) |
|
20 |
3 |
91 (3) 92 (4) |
|
|
30 |
3 |
90 (3) 92 (4) |
|
|
|
10 |
7 |
43 (3) 56 (4) |
|
20 |
4 |
88 (3) 90 (4) |
|
|
30 |
4 |
89 (3) |
Интересно использование ионной жидкости [bmim][PF6] в одностадийном синтезе замещенных 2-амино-7-метил-5-оксо-4,5-дигидропирано[4,3-6]пиранов.
Хороший выход пирано[4,3-6]пиранов (11а,b) заметен при замене EtOH на [bmini][PF6] в реакции пиранона 5, малононитрила 6 и алифатических альдегидов 7. При этом для осуществления реакции также нужно добавлять в реакционную массу в качестве катализатора Et3N. Эффективность применения [bmim][PF6], скорее всего, можно связать с различной скоростью элиминирования воды из образующегося в промежуточной стадии альдоля 8 в ионной жидкости и в EtOH [4].
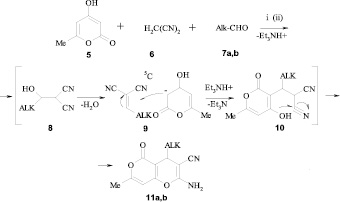
7, 11: ALK = СНМе2 (а); СН2СНМе2 (b)
Реагенты и условия: i) EtOH, Et3N, Δ; ii) [bmim][PF6], Et3N, 70 °С
Полученные результаты показывают, что осуществление альдольной конденсации в ионных жидкостях значительно увеличивает скорость реакции и выход продуктов конденсации [4].
Ионные жидкости в качестве растворителей могут многократно использоваться в реакциях. Например, это было показано в реакции СН-кислот 12, 13, 14, 15 с акролеином в ионной жидкости [bmim][PF6]. В результате реакции образуются с умеренными выходами аддукты Михаэля 16—19. Повышению выходов альдегидокислот 16—19 благоприятствует применение «мягкого» депротонирующего агента карбоната натрия и инициирование системы ультразвуком [5].
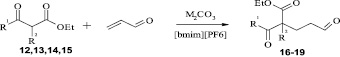
Ионную жидкость [bmim][PF6] регенерировали и использовали неоднократно в нескольких реакционных циклах без уменьшения выходов и чистоты продуктов присоединения. Практически количественная регенерация спектроскопически чистой ионной жидкости свидетельствует о том, что она не взаимодействует в изученных условиях с компонентами реакционной смеси, в частности с карбонатами металлов и анионами СН-кислот. Применение ионной жидкости [bmim][PF6] позволило повысить выход соединения 19, являющегося ключевым интермедиатом в синтезе 5,9-диметил-2-(3-N,N- диметиламинопропил)додека-4,8-диеновой кислоты – эффективного средства для лечения инфаркта миокарда [5].
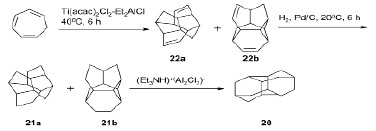
Диамантан 20 синтезирован с выходом 91–97 % путем скелетной изомеризации смеси гидрогенизированных димеров циклогепта-1,3,5-триена, пентацикло[8.4.0.03,7.04,14.06,11]тетрадекана 21а и пентацикло[7.5.0.02,8.05,14.07,11]тетрадекана 21b в соотношении 3 : 2 в присутствии ионной жидкости [Et3NH]+ [Al2Cl7]– [6].
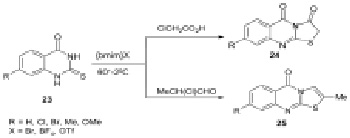
Известно о применении трех различных ионных жидкостей [bmim]X (X = Br, BF4, OTf) в реакции циклизации 2-тиоксо-2,3-дигидрохиназолин-4(1Н)-онов 23 с 2-хлороуксусной кислотой или 2-хлорпропанолом в атмосфере азота при температуре ~60 °C для синтеза производного тиазоло[2,3-b]-хиназолин-3,5(2Н)-диона 24 и производного 5Н-тиазоло-[2,3-b]хиназолин-5-она 25 соответственно. Наилучшие выходы соединений 24,25 получены при использовании [bmim]OTf (83-92 и 82-91 % соответственно) [7].
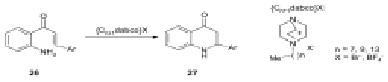
Современный эффективный синтез 2-арил-2,3-дигидрохинолин-4(1Н)–онов 27 был предложен с применением внутримолекулярной циклизации 2-аминохалконов 26, ускоряемой бромидом 1-октил-4-аза-1-азобицикло[2.2.2]октана ([C8dabco]Br). Возможность повторного использования катализатора, высокие выходы продуктов, простое выделение продуктов и высокая атомная эффективность – достоинства этого метода [8].
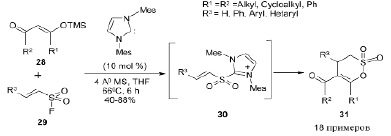
О получении N-гетероциклического карбен-катализируемого (NHC) δ-султона 31 с использованием триметилсилильных эфиров енола 28 и α,β-ненасыщенных сульфонилфторидов 29 через α, β-ненасыщенный сульфонилазолиевый интермедиат 30 сообщалось в работе [9]. Реакция умеренно чувствительна к электронным эффектам заместителей в исходных веществах: электронодефицитные и электроноизбыточные сульфонилфториды превращаются в соответствующие султоны практически с одинаковой скоростью. В этой удобной методике может быть использован как алифатический, так и ароматический триметилсилильный эфир енола. В случае несимметричных триметилсилильных эфиров енола региоселективность реакции была умеренной [9].
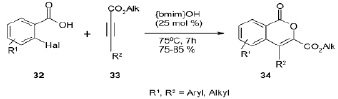
Разработана эффективная и экологически безопасная гетероциклизация о-галобензойной кислоты 32 с алкином 33 с использованием [bmim]OH в качестве «зеленого» катализатора. Эта методология дает высокие выходы, а также позволяет ввести различные функциональные группы. Выделение и повторное использование [bmim]OH позволяет широко использовать данную методологию [10].
Фитостеролы эффективны в снижении холестерина в плазме. Известно исследование, направленное на создание зеленого и высокоэффективного метода синтеза линолената фитостерола с использованием кислотной ионной жидкости Bronsted (IL) в качестве катализатора для улучшения растворимости фитостерола в масле. Продукт отделяли, анализировали и затем характеризовали с использованием тонкослойной хроматографии, инфракрасной спектроскопии и масс-спектрометрии. Преобразование фитостеролов может достигать 96 % за очень короткое время (30 мин) при следующих оптимальных условиях: 3 %-ный трифторметансульфонат 1-бутилсульфонат–3-метилимидазолия ([BSO3HMim]OTf) в качестве катализатора, 110 °С и 1: 1,75 М фитостеринов и этиллинолената. Установлено, что [BSO3HMim]OTf является потенциальным катализатором синтеза эфира фитостерола. Растворимость линолената фитостерола в масле должна быть намного больше, чем растворимость соответствующих свободных фитостеринов [11].
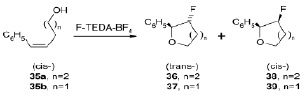
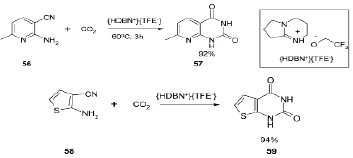
Фторциклизация цис-алкенолов 35а и 35b с помощью F-TEDA-BF4 была проведена в нитрометане и [emim][CF3SO3] в качестве реакционной среды. Фторциклизация цис-алкенола 35а в нитрометане при 25 °C и 80 °C, а также в [emim][CF3SO3] при 105 °C протекает с предпочтительным образованием цис-изомера 38 с низкой стереоселективностью. Интересно отметить, что снижение температуры реакции в ионной жидкости до 80 °C уменьшает выход цис-изомера 38. В случае фторциклизации цис-алкенола 35b в ионной жидкости при 80 °С цис-продукт 39 был получен с лучшей стереоселективностью по сравнению с реакцией в нитрометане [12].
Найдено, что ионные жидкости являются превосходными средами для реакций, катализируемых медью, например в реакции каталитического олефинирования. В результате появился новый зеленый подход к галогеноалкенам. Отмечена возможность проведения до 5 циклов реакции без регенерации катализатора и без снижения выхода целевых продуктов. В результате скрининга ряда различных ионных жидкостей было выявлено, что тетрафторборат 1-бутил-3-метилимидазолия ([bmim][BF4]) является наиболее эффективным растворителем. Мягкие условия, высокая атомная эффективность по сравнению с другими известными методами, низкое количество отходов и возможность извлечения и повторного использования ионной жидкости являются преимуществами предлагаемого метода [13].
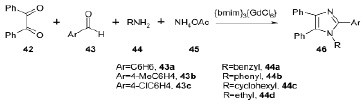
Магнитная ионная жидкость, три(1-бутил-3-метилимидазолий) гексахлорид гадолиния ([bmim]3[GdCl6]), была использована в качестве эффективного зеленого катализатора в one-pot синтезе 1,2,4,5-тетразамещенных имидазолов 46 путем конденсации бензила 42, ароматического альдегида 43, амина 44 и ацетата аммония 45. Отличная селективность, мягкие условия реакции, а также легкость выполнения эксперимента – только некоторые преимущества данного метода [14].
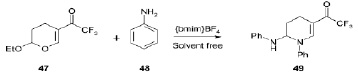
Функционализированные пиперидины или тетрагидропиридины имеют важное значение в качестве строительных блоков для синтеза многочисленных классов азотистых гетероциклических соединений, включая природные соединения. Методики синтеза, описанные в литературе для получения этого класса соединений, характеризуются сложностями выделения продуктов из смеси реагентов и их очисткой, требующей использования вредных органических растворителей при больших значениях температур, большой длительностью по времени и многостадийностью реакций. Ионные жидкости помогают в решении этих проблем. Известно о получении 1-арил-2-ариламино-5-трифторацетил-1,2,3,4-тетрагидропиридинов 49 из циклических енонов 47 и ариламинов 48 с отличными выходами (87–97 %), при этом продолжительность реакций варьировала в широком диапазоне в зависимости от используемого метода. В то же время при использовании тетрафторбората 1-бутил-3-метилимидазолия [bmim]BF4 при микроволновом облучении продолжительность реакции уменьшалась до 1 мин, что свидетельствует о синергетическом эффекте [15].
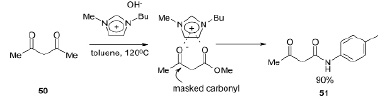
Ионная жидкость основания Бренстеда позволила осуществить селективный аминолиз сложного эфира 50 с получением ацетоацетамидных производных 51. Другая ионная жидкость, бромид 1-бутил-3-метилимидазолия, выполняет продуктивный катализ с использованием карбонильных групп ацетоуксусного эфира и о-фенилендиамина при высоких температурах с получением бензимидазолов с помощью разрыва связи C-C в промежуточном 1,5-бензодиазепиноне без растворителей [16].
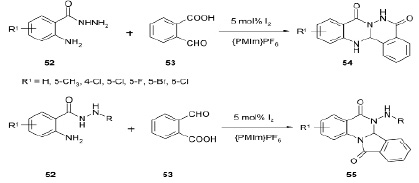
Хемоселективные реакции 2-аминобензогидразидов 52 и 2- формилбензойной кислоты 53, описанные в получении 5H-фталазино[1,2-b] хиназолина 54 и изоиндоло[2,1-a] хиназолина 55 осуществляются в ионных жидкостях, с использованием иода в качестве катализатора. Установлено, что тип продуктов зависит от стерического эффекта в 2-аминобензогидразиде [17].
R = 4-MeC6H4, Ph, 4-MeC6H4, 4-ClC6H4, Ph, Ph, 4-MeC6H4, Ph, Ph, 4-MeC6H4
R1 = 5-Br, 5-CH3, H, 5-Br, H, 5-Cl, 4-Cl, 5-Br, 5-CH3, 4-Cl
Разработана эффективная ионная жидкая система для получения пиримидин-2, 4(1H, 3H)–дионов с умеренными и отличными выходами (52–95 %). Обнаружено, что [HDBN +][TFE-], простая и легко получаемая ионная жидкость, может действовать как растворитель и катализатор реакции. Эти реакции могут эффективно осуществляться при взимодействии о-аминогетарилнитрилов с CO2 при атмосферном давлении [18].
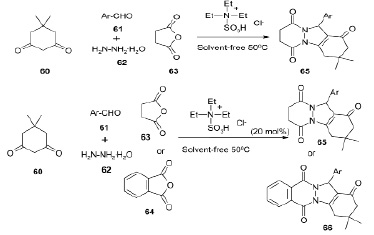
Был разработан быстрый и эффективный one-pot четырехкомпонентный синтез нового 2H-пиридазино[1,2-a]индазол-1,6,9(11H)–триона (65) и 2H-индазоло[2,1-b]фталазин-1,6,11-триона (66) с использованием стабильной и ионной жидкости Бренстеда, N, N-диэтил- N-сульфоэтанаммонийхлорида ([Et3N-SO3H]Cl). В этом превращении использовался ряд разнообразных альдегидов и получены соответствующие продукты с хорошими и отличными выходами без каких-либо побочных продуктов [19].
Сообщается об эффективном синтезе новых конденсированных пиридинов трехкомпонентной конденсацией альдегидов, койевой кислоты и 6-амино-1,3-диметилурацила, катализируемой ионной жидкостью гидросульфатом аминопропил-1,3,5-триазин-2,4-дифосфония. Катализатор наносился на функционализированный нанокремнезем в отсутствии растворителей. Бис-производные этих соединений легко синтезировали из диальдегидов. Этот метод имеет ряд преимуществ: мягкие условия, высокие выходы, короткое время реакции, легкое выделение и экологичность процесса. Кроме того, катализатор можно легко выделить из реакционной смеси, регенерировать и неоднократно использовать без заметного снижения каталитической активности [20].
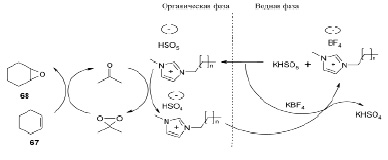
Установлено, что ионные жидкости катализируют эпоксидирование сахаров, работая как межфазные катализаторы. 1,2-Ангидросахара синтезированы реакцией окисления диметилдиоксирана, образующегося in situ из оксона и ацетона с участием амфифильных ионных жидкостей в качестве катализаторов. b-O-гликозиды синтезированы с хорошими выходами путем раскрытия эпоксидного цикла углеводных производных под действием нуклеофилов. Кроме того, этим способом могут быть получены 3,4,6-бензилзащищенные углеводы и b-N-гликозиды [21]. На схеме, приведенной ниже, показано эпоксидирование циклогексена 67 диметилдиоксираном при участии ионной жидкости с образованием эпоксидного производного 68.
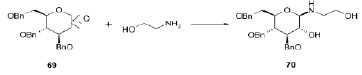
Раскрытие эпоксидного цикла 1,2-ангидросахара 69 под действием этаноламина с образованием соответствующего производного 70 проиллюстрировано ниже на схеме.
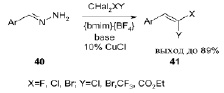
Предложен высокоэффективный и удобный метод получения симметричных биарилов 72 из солей арилдиазония 71 с использованием небольших количеств Pd(OAc)2 и доступных ионных жидкостей на основе имидазола, без окислителей, летучих растворителей, лигандов и добавок. Высокий выход продукта, легкое выделение, регенерация и повторное использование ионных жидкостей являются важными преимуществами этого метода [22].
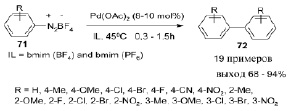
Синтезированы серии новых ионных жидкостей, обладающих хорошей экологичностью, вязкостью, способностью к регенерации и неоднократному использованию без предварительной очистки [23–25]. Реакции с этими ионными жидкостями отличаются мягкими условиями, короткой продолжительностью процесса, легкостью выделения продукта и их хорошими выходами [26–28].
Библиотека новых бифункциональных полициклических структур 73 была впервые синтезирована в ионной жидкости, в бромиде 1-бутил-3-метилимидазолия, в условиях микроволнового облучения, в одном реакторе трехкомпонентной реакцией [3+2]-циклоприсоединения с последующим аннелированием, с хорошими и отличными выходами. Созданные таким образом циклические системы содержат в качестве структурных элементов мостиковые, конденсированные и спиросочлененные кольца с полной регио- и стереоселективностью через образование двух C-C и двух C-N связей, что ведет к образованию двух азагетероциклических колец и пяти смежных стереогенных атомов углерода, три из которых являются четвертичными [29].
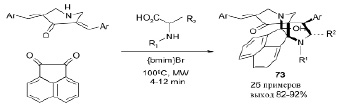
Ar = Ph, 2-MeOC6H4, 2-ClC6H4, 2-BrC6H4, 4-ClC6H4, 4-BrC6H4, 4-FC6H4
R1 = H, R2 = Ph
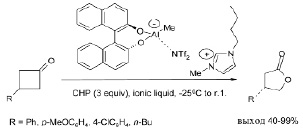
Описана новая каталитическая система для асимметричного окисления монозамещенных прохиральных циклобутанонов по реакции Байера – Виллигера с γ-бутиролактонами с высоким выходом (40–99 %) и энантиоселективностью (45–87 %). Представлены алюминиевые комплексы с биарильными лигандами и ионными жидкостями. Включение ионной жидкости в сложную структуру подтверждается наблюдаемой четырехкоординатной природой алюминия [30].
Таким образом, анализ литературных данных показывает, что ионные жидкости широко используются в органическом синтезе как «зеленые» растворители и как каталитические среды для получения различных классов органических соединений.
Библиографическая ссылка
Чабакова А.К., Щепетова Е.В., Абдурахманова Н.М. ИОННЫЕ ЖИДКОСТИ В ОРГАНИЧЕСКОМ СИНТЕЗЕ // Успехи современного естествознания. 2018. № 12-1. С. 216-226;URL: https://natural-sciences.ru/ru/article/view?id=37000 (дата обращения: 26.02.2026).
DOI: https://doi.org/10.17513/use.37000