Известно, что сточные воды, содержащие радионуклиды и тяжелые металлы, негативно прямо или косвенно влияют на окружающую среду [1]. В отличие от органических загрязнителей, радионуклиды и тяжелые металлы не являются биодеградируемыми [1] и не подвергаются бактериальной очистке и другим процессам разрушения или деградации [2], они биоаккумулируются [3]. В настоящее время существует множество методов, которые используют для удаления и извлечения радионуклидов из окружающей среды [4; 5], среди них наиболее распространенными являются химическое осаждение [5], ионный обмен [6], электроосаждение [7], мембранная технология [8], обратный осмос, нанофильтрация, нейтрализация известью, фиторемедиация [9] и электродиализ [10]. Однако с использованием этих традиционных методов очистки не удается полностью удалить радионуклидов и ионы металлов из загрязненных почв и воды [11]. Большинство методов требуют глубокой стадии последующей обработки [11]. Кроме того, большинство из указанных методов являются неэкономичными и имеют ряд недостатков, таких как неполное их удаление, высокая стоимость реагентов, а также образование токсичного ила или других отходов, которые требуют удаления или дальнейшей обработки [12]. Наиболее эффективными являются сорбционные методы, однако большинство традиционных сорбентов являются неспецифическими и проявляют низкую селективность [13]. Исходя из этого, необходимо получить новые селективные сорбенты с использованием полимеров с молекулярными отпечатками, а именно ион–импринтированные полимеры (ИИП). Добавление магнитных наночастиц в ИИП позволяет использовать технику магнитной сепарации для удаления токсикантов из загрязненной среды. Возможность создания и эффективность подобных ИИП была показана в работах [14; 15]. Авторами предложены ион˗импринтированные сорбенты, полученные на основе магнетита и гуминовых кислот, в качестве темплата использованы Cu2+, Ni2+, UO22+, сшивающим агентом являлся формалин [14; 15]. Молекулярный импринтинг представляет собой сборку сшитой полимерной матрицы вокруг молекулы отпечатка, которая удерживается благодаря ковалентным или нековалентным связям между функциональными мономерами. Удаление молекулы отпечатка образует полость определенного размера и формы. Между матрицей и мономерами происходит ионное взаимодействие, образуются ион-импринтированные полимеры. Таким образом, после удаления матрицы полимер содержит специфическую химическую «память» на участках, которые избирательно способны к его обратному поглощению темплата. Такой продукт обычно называют молекулярно-импринтированным полимером (MИП). Пока реакция полимеризации не завершена и продукты реакции находятся в гелеобразном состоянии, то можно получать различные формы MИП, такие как полимерные монолиты, мембраны, микросферы и наносферы для различного их применения. Общая методика синтеза MИП обобщена и представлена на рис. 1.
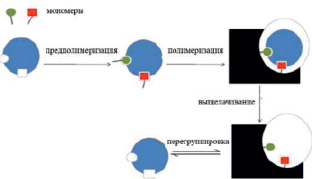
Рис. 1. Схема образования МИП
Ион-импринтированные полимеры (ИИП) аналогичны MИП, но они могут распознавать ионы металлов после импринтинга и сохранять все свойства MИП. Селективность ИИП обусловлена специфичностью лиганда, а именно координационной геометрией комплекса ион-матрицы, координационным числом ионов, зарядами ионов и их размерами. Процесс синтеза ИИП является легким, недорогим, и полученные полимеры являются стабильными, универсальными и устойчивыми к широкому диапазону рН растворителей и температур.
Цель исследования: синтез магнитных ион-импринтированных полимеров для селективной сорбции UО22+ из сточных вод, содержащих как UО22+, так и другие конкурирующие ионы металлов. Определить оптимальные условия проведения синтеза, а именно: влияние рН˗среды на максимальную сорбцию UО22+, покрытым магнетитом, зависимость концентрации покрытого магнетита от максимальной сорбции UО22+, время взаимодействия комплекса с UО22+ с покрытым магнетитом.
Материалы и методы исследования
Для синтеза магнетита использованы соли FeCl2∙4H2O и FeCl3∙6H2O, раствор NH4OH. Синтез наночастиц магнетита проводили путем совместного осаждения солей Fe2+ и Fe3+ в щелочной среде [16]. К 180 мл водного раствора, содержащего 11,2 ммоль Fe3+ и 5,6 ммоль Fe2+, нагретого до 50 °C при энергичном перемешивании добавляли 12,5 мл 10 % NH4OH и выдерживали при 90 °C в течение 30 мин. После завершения реакции образовавшийся черный осадок собирали магнитом, промывали водой и этанолом, полученный магнетит сушили в вакууме.
В смесь, содержащую диспергированные наночастицы Fe3O4, добавляли 4 мл γ˗метакрилоксипропилтриметоксисилана (γ˗MPS), растворители этанол и вода в соотношении (1:1) (табл. 1), затем оставляли на сутки. Образованный продукт отделяли и несколько раз промывали этанолом и сушили в вакууме.
Таблица 1
Состав промывочного раствора
|
Номер раствора |
1 |
2 |
3 |
4 |
5 |
|
Этанол (мл) |
10 |
6 |
5 |
4 |
0 |
|
Вода (мл) |
0 |
4 |
5 |
6 |
10 |
Исходный раствор соли урана (VI) готовили растворением соответствующего количества навески соли (UO2 (NO3)2·6H2O) в 1 л дистиллированной воды.
Магнитные ион˗импринтированные полимеры получали в соответствии [17] с некоторой модификацией. Методика получения: из исходного раствора UO22+ 1000 мг/л взяли 25 мл, что составило 2 мг/л урана, и добавили 2 ммоль салицилальдоксима (CALO) и 2 ммоль 4-винилпиридина (4-VP), затем смесь смешивали с 12 ммоль метакриловой кислоты (MAA). К полученному комплексу с UO22+ добавили 2 г γ – MPS – Fe3O4 суспензированного в 10 мл 2˗метоксиэтанола. Затем для сшивки магнитоактивного ион˗импринтированного полимера прилили 36 ммоль диметакрилата этиленгликоля (ЭGDMA). Смесь оставляли для охлаждения. Затем магнитоактивный ион˗импринтированный полимер собирали магнитом и промывали раствором этанола и воды в соотношении 1:1 и сушили при 70 °С. По той же методике получали магнитоактивный ион˗импринтированный полимер, где в качестве стабилизатора наночастиц магнетита использовали олеиновую кислоту (ОА). Полученные магнитоактивные ион˗импринтированные полимеры измельчали и просеивали через сито (53 мкм).
Влияние рН-среды на максимальное связывание UO22+ с γ – MПС – Fe3O4 проводили при рН = 2–9. Для корректировки pH использовали следующие буферные растворы (табл. 2).
Таблица 2
Буферные растворы, использованные для корректировки рН˗среды
|
рН |
1; 2 |
3 |
4; 5; 6 |
7; 8; 9 |
|
Буферный раствор |
HCl/KCl |
Na2HPO4/лимонная кислота |
CH3COOH/CH3COONa |
бура/H3BO3 |
Из исходного раствора UO22+ взяли по 25 мл и перенесли в колбочки, прилили 2 ммоль салицилальдоксима, 2 ммоль 4-винилпиридина, 12 ммоль метакриловой кислоты, прилили соответствующего буферного раствора, добавили 20 мг γ – MPS – Fe3O4, затем прилили 36 ммоль диметакрилата этиленгликоля. После этого смеси перемешивали со скоростью 1500 об/мин и оставили для установления равновесия. Также по той же методике получали образцы, но в качестве стабилизированных частиц магнетита использовали ОА – Fe3O4.
Определяли влияние концентрации γ – MPS – Fe3O4 на максимальное связывание UO22+, эксперимент проводили при комнатной температуре. Использовали ту же методику, что описана выше, но варьировали концентрацию γ – MPS – Fe3O4 от 10 до 100 мг. После перемешивания смеси оставляли на 1 час. Затем раствор анализировали на содержание UO22+, из которого рассчитывали количество, сорбированное магнитным полимером.
Определение оптимального времени связывания UO22+ с γ – MPS – Fe3O4 и ОА – Fe3O4 проводили при различном временном интервале (10–90 мин). В колбочки приливали по 25 мл исходного раствора UO22+ и добавляли оптимизированное количество γ – MПС – Fe3O4 и ОА – Fe3O4 соответственно. Через каждые 10 минут определяли количество связанных UO22+. Смесь перемешивали при комнатной температуре при скорости 1500 об/мин, после оставляли до установления равновесия.
Повторное использование магнитных урановых ИИП
Для проверки стабильности и повторного использования магнитных урановых ИИП к 25 мл раствора уранила с исходной концентрацией 2 мг/л добавляли 50 мг выщелоченных магнитных ИИП. Через 45 мин экстракции и равновесного водного раствора сорбенты фильтровали и переносили в другую колбочку для выщелачивания урана с 25 мл 1 М раствора HCl со скоростью перемешивания 1500 об/мин при комнатной температуре в течение 45 мин. Полученные магнитные ИИП затем использовали для последующих исследований сорбции по отношению к ионам уранила.
Результаты исследования и их обсуждение
Образование комплекса между 4 – VP, САLО, МАA и UO22+, присутствующими в образце, зависит от рН. Низкое значение рН характеризуется более высокой концентрацией H+, которая влияет на прочность образованного комплекса UO22+ с функциональными мономерами, где происходит протонирование аминогруппы, т.е. концентрация нуклеофила падает. Хелатирующие NH2-группы и OH-группы в полимерной матрице электростатически отталкивают UO22+. В результате образуется непрочный комплекс с UO22+. При выщелачивании темплатов из комплекса возможно его разрушение, что приведет к образованию смесей, которые не являются ион-импринтированными полимерами. Создание определенной рН˗среды является обязательным для образования прочного комплекса с покрытыми магнитными наночастицами UO22+, где максимальное количество UO22+ связывается с γ – MPS – Fe3O4. Как видно из рис. 2 и 3, максимальное связывание UO22+ с γ – MPS – Fe3O4 наблюдается при рН = 4.
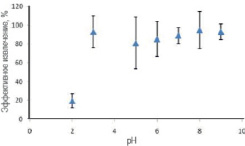
Рис. 2. Влияние рН на максимальное связывание UO22+ с γ – MPS – Fe3O4
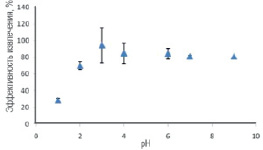
Рис. 3. Влияние рН на максимальное связывание UO22+ с OA – Fe3O4
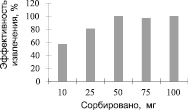
Рис. 4. Эффективность сорбции UO22+ γ – MPS – Fe3O4. Экспериментальные условия: pH = 4; объем образца 25 мл; концентрация урана 2 мг/л; время контакта 45 минут; скорость перемешивания 1500 об / мин; комнатная температура
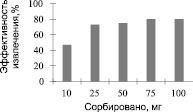
Рис. 5. Эффективность сорбции UO22+ OA – Fe3O4. Экспериментальные условия: pH = 4; объем образца 25 мл; концентрация урана 2 мг/л; время контакта 45 минут; скорость перемешивания 1500 об/мин; комнатная температура
На рис. 4, 5 показана зависимость сорбированного количества UO22+ от концентрации γ – MPS – Fe3O4 и ОА – Fe3O4. Оба образца показали, что с увеличением концентрации γ – MPS – Fe3O4 и ОА – Fe3O4 количество сорбируемых UO22+ соответственно возрастает до постоянной величины. Оптимальная концентрация при максимальной сорбции для γ – MPS – Fe3O4 составила 50 мг, а для ОА – Fe3O4 составила 75 мг.
Время полного взаимодействия между количеством UO22+ и γ – MPS – Fe3O4, ОА – Fe3O4 соответственно показаны на рис. 6, 7. Из рис. 5 и 6 видно, что в течение времени от 0 до 45 минут наблюдалось увеличение количества сорбированных UO22+ γ – MPS – Fe3O4 и ОА – Fe3O4, после чего наступало равновесие.
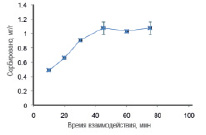
Рис. 6. Влияние времени взаимодействия на сорбцию UO22+ γ – MPS – Fe3O4. Экспериментальные условия: pH = 4; объем образца 25 мл; концентрация урана 2 мг/л; γ – MPS – Fe3O4 50 мг; скорость перемешивания 1500 об / мин; комнатная температура
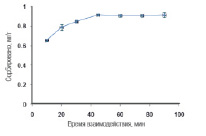
Рис. 7. Влияние времени взаимодействия на сорбцию UO22+ ОА – Fe3O4. Экспериментальные условия: pH = 4; объем образца 25 мл; концентрация урана 2 мг/л; ОА – Fe3O4 75 мг; скорость перемешивания 1500 об/мин; комнатная температура
Дальнейшее увеличение времени контакта между UO22+ и γ – MPS – Fe3O4, а также UO22+ и ОА – Fe3O4 не повлияло на сорбцию. Оптимальным временем сорбции UO22+ для γ – MPS – Fe3O4 и для ОА – Fe3O4 является 45 мин.
Использование магнитных ИИП при повторном выщелачивании темплатов составило 85 %. Это доказывает пригодность магнитных ион–импринтированных сорбентов для селективного удаления урана из сложных загрязненных водных сред.
Заключение
Синтезированы магнитоактивные ион-импринтированные полимеры, селективные по отношению к UО22+. Определены оптимальные условия проведения синтеза для максимальной сорбции UО22+ магнитоактивными ион-импринтированными полимерами, показано влияние рН˗среды на максимальную сорбцию UО22+, установлена зависимость концентрации покрытого магнетита по отношению UО22+, определено время полного взаимодействия комплекса UО22+ с покрытым магнетитом.
Библиографическая ссылка
Касымова Э.Дж., Кыдралиева К.А., Жоробекова Ш.Ж. ПОЛУЧЕНИЕ И СОРБЦИОННЫЕ СВОЙСТВА МАГНИТНЫХ ИОН˗ИМПРИНТИРОВАННЫХ ПОЛИМЕРОВ ПО ОТНОШЕНИЮ К UO22+ // Успехи современного естествознания. 2019. № 3-2. С. 139-144;URL: https://natural-sciences.ru/ru/article/view?id=37083 (дата обращения: 18.02.2026).



