L-лизин и L-аргинин – это диаминомонокарбоновые аминокислоты, по характеру заряженности боковых радикалов относятся к полярным аминокислотам с положительным зарядом, т.е. содержащие положительно заряженные R-группы.
L-аргинин является одной из наиболее важных универсальных аминокислот, участвующей в метаболизме. Экспериментальные исследования на животных показали, что экзогенное потребление L-аргинина имеет многократные положительные фармакологические эффекты: снижение риска сердечно-сосудистых заболеваний, снижение эректильной дисфункции, улучшение иммунитета и ингибирование повышенной кислотности желудка [1].
L-лизин является незаменимой аминокислотой, поскольку организм не может его синтезировать. В настоящее время наблюдается увеличение числа экспериментальных работ по применению L-лизина в сельском хозяйстве [2–3].
L-аргинин является природной аминокислотой, в которой образуется цвиттер-ион не только в слабощелочных и нейтральных растворах, но и в газовой фазе. Экспериментальные результаты [4] свидетельствуют, что промерзающий димер аргинина представляет собой солевой мостик, в котором одна из молекул аргинина существует как цвиттер-ион. В [5] исследовалась подвижность ионов протонированного, седированного и цезированного аргинина. В [5–6] представлены результаты исследований щелочно-катионного аргинина, образующего стабильные положительно или отрицательно заряженные агрегаты, связанные солевым мостиком.
Экспериментальные и теоретические работы по исследованию физико–химических свойств аминокислот немногочисленны. В статье [7] методом рентгеновской дифракции была определена кристаллическая структура L-аргинина. Экспериментальные ИК- и КР-спектры молекулы L-аргинина, измеренные при комнатной температуре, представлены в работе [8]. ИК-измерения суспензии аргинина [8] в вазелиновом масле проводились ИК-спектрофотометром с преобразованием Фурье в диапазоне частот 4000–400 см-1. Рамановскую спектроскопию [8] регистрировали с использованием ISB Jobin – Yvon Spex HR-320, монохроматора (600 г / мм решетки).
Цель исследования. Теоретические работы по изучению физико-химических свойств данных аминокислот практически отсутствуют, поэтому целесообразно выполнить расчеты по оптимизации структуры и изучить физико-химические свойства молекул диаминомонокарбоновых аминокислот L–аргинина и L–лизина и сопоставить их с экспериментальными данными.
Матеиалы и методы исследования
Для исследования электронной структуры молекул L-лизина и L-аргинина использовался комплекс программ CRYSTAL17 [9]. Расчеты были выполнены методом DFT с гибридным функционалом B3LYP и базисными наборами из [10]. Геометрия молекул получена путем минимизации полной энергии и равнодействующих сил.
Результаты исследования и их обсуждение
Полученная структура молекул L-лизина и L-аргинина в свободном состоянии совпадает с общепринятыми. На рис. 1 приведены модели оптимизированной структуры свободных молекул данных аминокислот с обозначением соответствующих атомов.
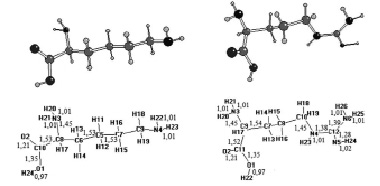
Рис. 1. Молекула L-лизина (слева) и L-аргинина (справа)
В структуре молекул соответствующих аминокислот можно выделить две функциональные группы: аминогруппу – NH2 и карбоксильную группу – СООН, связанные с углеводородным радикалом, включающим аминогруппы.
В структуре молекулы L-аргинина угол между атомами, входящими в состав аминогруппы, составляет 108,496 °, тогда как в L-лизине этот угол равен 101,241 °. Межатомные расстояния в группе NH2 также имеют соответствующие различия. В молекуле L-лизина расстояние N3-H20 = 1,019 Å и N3-H21 = 1,017 Å, а в молекуле L-аргинина те же характеристики равны 1,016 Å и 1,014 Å. В молекуле радикала L-лизина четко прослеживается цепочечная структура атомов углерода с углами, принимающими значения от 109,485 ° между С10-С8-С6 и 113,06 ° между С9-С7-С5. Радикал молекулы L-аргинина, по сравнению с L-лизином, имеет более скрученную структуру, включающую в себя атомы азота. Угол между атомами углерода С9-С7-С8 в молекуле L-аргинина равен 113,238 °, а С7-С8-С10 – 114,133 °. Атом С10 связан с атомом азота N4 на расстоянии 1,456 Å, в то время как следующий атом углерода С12 находится на расстоянии 1,387 Å, угол же между этими атомами составляет 124,249 °. В «хвосте» радикала L-аргинина к атому углерода С12 присоединены три атома азота: N4, N6 и N5. При этом атом азота N5 находится ближе к углероду С12, расстояние между ними составляет 1,287 Å, тогда как между С12 – N6 и С12 – N4 – 1,398 и 1,387 соответственно. Атом азота N6 вместе с атомами водорода образуют аминогруппу, входящую в состав радикала. Угол между соответствующими атомами равен 112,419 °, расстояния равны расстояниям между атомами, входящими в состав функциональной аминогруппы. К атомам азота N4 и N5 присоединены атомы водорода H23 и H24 на расстояниях 1,011 и 1,020 Å.
Полная энергии в молекуле L-лизина равна – 4,967∙102 а.е., тогда как молекуле L-аргинина – 5,302∙102 а.е. Кинетическая энергия в молекуле L-аргинина принимает значение 5,285∙102 а.е., превышая соответствующее значение молекулы L-лизина (4,936∙102 а.е.). Энергии Ферми, в рассматриваемых аминокислотах, имеют близкие значения: –0,225 а.е. в молекуле L-лизина и –0,157 а.е. в молекуле L-аргинина.
Электронная структура и химическая связь в молекулах L-лизина и L-аргинина ранее не изучались. Для анализа электронной структуры мы использовали карты электронных, разностных плотностей в различных плоскостях. Разностная плотность указывает перераспределение заряда по отношению к пространственному распределению электронов в свободных атомах, определяется вычитанием из молекулярной плотности плотностей свободных атомов. На картах разностной плотности положительным значениям отвечают сплошные линии, отрицательным – пунктирные.
На рис. 2, 3 приведены карты электронных (слева) и разностных (справа) плотностей для функциональных групп молекулы L-лизина и L-аргинина в различных плоскостях. На картах электронной плотности в различных плоскостях прослеживаются общие контурные линии, которые включают все атомы, лежащие в данной плоскости.
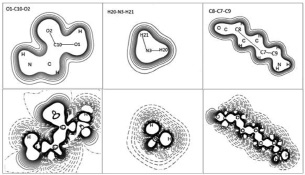
Рис. 2. Карты электронной (сверху) и разностной (снизу) плотностей молекулы L-лизина в плоскостях O1-C10-O2 (слева), H20-N3-H21 (в центре), C8-C7-C9 (справа)
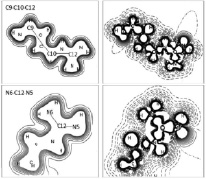
Рис. 3. Карты электронной (слева) и разностной (справа) плотностей молекулы L-аргинина в плоскостях C9-C10-C12 (сверху), N6-C12-N5 (снизу)
Рассмотрим механизм образования химической связи в функциональных группах молекул L-лизина и L-аргинина.
Эффективные заряды атома азота N3, атомов водорода H20 и H21, входящих в состав аминогруппы молекулы L-лизина, равны соответственно –0,555|e|, +0,246|e|, +0,240|e|, тогда как заселенности перекрывания PN3-H20 = 0,342|e| и PN3-H21 = 0,344|e| (е – заряд электрона). В молекуле L-аргинина заселенности перекрывания между атомами N3, H20 и H21 также принимают близкие значения, PN3-H20 = 0,337|e| и PN3-H21 = 0,336|e|, а эффективные заряды атомов водорода H20 и H21 равны +0,260|e| и +0,239|e|. На карте разностной (справа) плотности H20-N3-H21 молекулы L-лизина (рис. 2 (в центре)) видно, что заряд вытекает из внешних областей атомов азота и водорода и натекает на линии связи N3-H20 и N3-H21, образуя одновалентную группу – NH2. Для аминогруппы, входящей в состав радикала молекулы L-лизина, образование химической связи происходит аналогично (QН22 = +0,229|e|, QН23 = +0,231|e|, PN4-H22 = 0,342|e| и PN4-H23 = 0,337|e|).
В молекуле L-лизина эффективный заряд атома углерода С10 принимает положительное значение, равное = +0,500|e|, это объясняется тем, что карбоксильная группа аминокислот обладает акцепторным эффектом и оттягивает на себя электронную плотность с атома азота аминогруппы. Так, в молекуле L-аргинина заряд атома углерода, входящего в состав карбоксильной группы, равен +0,535|e|. Заряды атомов в молекуле L-лизина QН24 = +0,323|e|, QО1 = –0,473|e| и QО2 = –0,432|e|, при этом заселенность перекрывания между атомами кислорода О2 и углерода С10 (PO2-C10 = 0,628|e|) превышает PO1-C10 = 0,259|e|, а PO1-H24 принимает значение 0,271|e|. В молекуле L-аргинина соответствующие заряды группы СООН: QН22 = +0,329|e|, QО1 = –0,471|e| и QО2 = –0,429|e|, заселенности перекрывания PO1-H22 = 0,277|e|, PO1-C11 = 0,287|e| и PO2-C11 = 0,617|e|. На рисунке (справа) видно, что на линиях связи C-O и O-H наблюдается натекание заряда, что характерно для ковалентной связи. Таким образом, для карбоксильной группы аминокислот показано образование σp-p связи между атомами углерода и кислорода.
При рассмотрении карт электронных (слева) и разностных (справа) плотностей молекулы L-лизина в плоскости C8-C7-C9 (рис. 2 (снизу)) видно, что радикал молекулы L-лизина представляет собой цепочечную структуру связанных σp-p связью CH2 – групп в одну линию (рис. 2 (справа)) с аминогруппой на конце. Группы CH2 имеют общие контурные линии, и наблюдаются выраженные перекрывания гибридных sp-орбиталей атомов углерода с атомами водорода (рис. 3 (снизу)). Эффективные заряды атомов углерода С5, С6, С7 равны –0,171|e|, –0,170|e|, –0,167|e| соответственно. Заселенности перекрывания атомов углерода с атомами водорода принимают значения от 0,375|e| до 0,386|e|. Эффективный заряд атома углерода QС9 = –0,057|e| можно объяснить соседством с группой NH2, в которой атом азота приобретает заряд –0,585|e|, заселенность перекрывания между ними PС9-N4 = 0,316|e|. Вид радикала молекулы L-аргинина по сравнению с молекулой L-лизина выглядит более скрученным (рис. 3), однако можно проследить общие закономерности. Атомы углерода С7, С8 и С10, имеющие эффективные заряды –0,162|e|, –0,207|e| и –0,046|e| соответственно, с заселенностями перекрывания PС7-С8 = 0,353|e| и PС8-С10 = 0,332|e|, образуют цепочку связанных между собой групп CH2. Электронная структура аминной группы, расположенной в «хвосте» радикала молекулы L-аргинина, а также связь в группе CH2 данной аминокислоты также совпадает с электронной структурой подобных элементов молекулы L-лизина. Отличие состоит в том, что атом углерода С12, имеющий положительный эффективный заряд +0,490|e|, связан с тремя атомами азота, заряды которых равны QN4 = –0,489|e|, QN5 = –0,553|e| и QN6 = –0,594|e|. Заселенности перекрывания между атомами принимают следующие значения: PN4-C12 = 0,317|e|, PN6-C12 = 0,313|e|, PN5-C12 = 0,674|e|. Положительное значение эффективного заряда атома углерода С12 соответствует перетеканию заряда на атомы азота. На картах разностной плотности (рис. 3 (снизу)) наблюдаются sp-гибридизация атомов углерода С12 и азотов N4, N5 и N6.
Наивысшая заполненная молекулярная орбиталь молекулы L-лизина (HOMO) состоит из s– и py-орбиталей атома азота N4, входящего в состав радикала, s–орбитали атома углерода C7, py-орбиталей атома углерода С9, а также s-орбиталей атома водорода H18. В молекуле L-аргинина HOMO также состоит из орбиталей атомов, входящих в состав радикала данной аминокислоты: s-орбитали атома азота N4, py- и pz-орбиталей атомов азота N4, N5, pz-орбиталей атома азота N6, pz-орбитали атома углерода C12, а также s-орбиталей атома водорода H18. Низшая незанятая молекулярная орбиталь молекулы L-лизина (LUMO) состоит из px-, py-, pz-орбиталей атомов кислорода O1,O2 и углерода C10, входящих в состав карбоксильной группы, s- и px-орбиталей атома углерода C5, s- и px-, py-орбиталей атома углерода C6, px-, pz-орбиталей атома углерода C8, и s-орбиталей атома водорода H17. В молекуле L-аргинина низшая незанятая молекулярная орбиталь (LUMO) состоит из px-, pz –орбиталей атомов кислорода O1 и px-, py- и pz-орбиталей атомов кислорода O2, s-, px-, py-, pz-орбиталей атома углерода C11, s-орбитали атома азота N3, s- и px-, py-орбиталей атома углерода C7, px-орбитали атома углерода C8, px-, py-, pz-орбиталей атома углерода C9, и s- орбитали атомов водорода H14, H17, H21.
ИК-спектры молекул L-лизина и L-аргинина, рассчитанные в данной работе, показаны на рис. 4, где также приводится экспериментальный ИК-спектр молекулы L-аргинина [8].
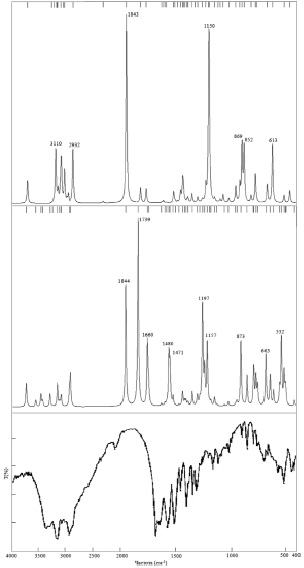
Рис. 4. Теоретический ИК-спектр молекулы L-лизина (сверху), теоретический (в центре) и экспериментальный (снизу) ИК–спектры L-аргинина и в интервале частот от 400 до 4000 см-1
ИК-спектры исследуемых молекул представляют собой чередование частот различной интенсивности. Максимальной интенсивности в ИК-спектре молекулы L-аргинина соответствует частота 1739 см-1, обусловлена колебанием группы NH в радикале. Следующий по интенсивности пик наблюдается при 1844 см-1. В ИК-спектре же L-лизина частота 1843 см-1 соответствует максимуму интенсивности. При изгибе группы NH возникает полоса в ИК-спектре L-аргинина при 1660 см-1 (1680 см-1). Широкая полоса наблюдается при 1480 см-1 (1464 см-1), что связано с асимметричным изгибанием группы СН3. При 1197 см-1 наблюдается пик интенсивности в ИК-спектре молекулы L-аргинина из-за растяжения СО-группы.
Следующий максимум соответствует частоте 1157 см-1 для молекулы L–аргинина, 1150 см-1 – для молекулы L–лизина, обусловлен растяжением симметричной связи CC. Частота 873 см-1 (896 см-1) в ИК-спектре молекулы L–аргинина появляется из-за вибрации группы NH2. Для L-лизина широкая полоса большой интенсивности соответствует 869 см-1. Частота 764 см-1 (794 см-1) появляется в ИК спектре L–аргинина из-за растяжения группы CNH. Максимумы интенсивности, соответствующие частотам 627 см-1 (624 см-1) в L–аргинина и 613 см-1 в L–лизина, вызваны вибрацией карбоксильной группы. Частота 532 (522 см-1) появляется в ИК спектре L–аргинина из-за изгиба CO-группы. Частоты 2948 см-1 (2928 см-1) и 2932 см-1 появляются из-за асимметричного растяжения группы СН3 в ИК-спектре молекул L-аргинина и L-лизина соответственно. Максимум при 3110 см-1 в ИК-спектре молекулы L-лизина обусловлен колебанием группы СН, входящей в состав цепочечной структуры аминокислоты.
Выводы
Предложенный расчетный метод DFT с обменно-корреляционным функционалом B3LYP и базисами [10] при сравнении с экспериментальными данными хорошо описывает исследуемые соединения. Оптимизированная структура молекул L-лизина и L-аргинина совпадает с общепринятыми структурами. Впервые была изучена электронная структура и химическая связь в молекулах L-лизина и L-аргинина. Рассчитаны эффективные заряды атомов исследуемых молекул и заселенности перекрывания их с ближайшими соседями, а также карты распределения электронных и разностных плотностей для функциональных групп молекул L-лизина и L-аргинина в различных плоскостях. Показано, что в молекулах аминокислот эффективный заряд атома углерода группы СООН принимает положительное значение из-за акцепторного эффекта карбоксильной группы, которая оттягивает на себя электронную плотность с атома азота аминогруппы. Рассмотрен механизм образования σp-p связи между атомами углерода и кислорода для карбоксильной группы аминокислот. Приведено сравнение ИК-спектра молекул L-лизина и L-аргинина. Таким образом, результаты, полученные в данной работе, могут быть использованы для исследования физико-химических свойств комплексов, содержащих данные аминокислоты.
Библиографическая ссылка
Оболонская О.С., Головко О.В., Салтанова Е.В. ИССЛЕДОВАНИЕ МЕХАНИЗМА ОБРАЗОВАНИЯ ХИМИЧЕСКОЙ СВЯЗИ, КОЛЕБАТЕЛЬНЫХ И ЭЛЕКТРОННЫХ СВОЙСТВ L-ЛИЗИНА И L-АРГИНИНА // Успехи современного естествознания. 2019. № 3-2. С. 162-168;URL: https://natural-sciences.ru/ru/article/view?id=37087 (дата обращения: 04.02.2026).



