В связи с активным освоением Арктики большое внимание уделяется приморским побережьям арктических морей, куда входит и Белое море. Моря Северо-Запада России относятся к приливным морям, в которые впадают реки и где образуются эстуарные территории. Морские побережья являются зонами контакта между наземными и морскими экосистемами [1]. Эти территории относятся к наиболее нестабильным, так как дважды в сутки за счет приливно-отливной волны на них происходит смена водной и воздушной сред, что приводит к изменению всех климатических условий. Эти территории заливаются пресной водой больших рек, которые несут в том числе и сточные воды с освоенных человеком территорий и солеными морскими водами, которые движутся от северных морей через горло Белого моря к приморским территориям вдоль Карельского берега.
На приморских территориях ведущую роль играет литораль, которая в первую очередь подвергается всем вышеперечисленным воздействиям. На ее основной части – приливно-отливной зоне произрастают уникальные галофиты – высшие наземные сосудистые растения, которые адаптированы прежде всего к тому, чтобы дважды в сутки на 2–3 ч в период прилива полностью уходить под воду, а затем на воздушную среду, тоже на 2–3 ч – осушку. Эта группа растений – приморский галофитный комплекс – активно изучается разными исследователями [2, 3]. Поскольку растения литорали испытывают наиболее сильное воздействие приливно-отливных течений в таком стрессовом режиме, то встает вопрос об адаптации галофильного комплекса высших сосудистых растений к этим условиям и возможности поглощения и накопления ими тяжелых металлов.
Цель работы: исследовать накопление тяжелых металлов в грунтах, морской воде и доминантных видах галофитов: триостренника морского (Triglochin maritima L.) и подорожника морского (Plantago maritima L.) – в условиях эстуария Керетской губы Белого моря.
Материалы и методы исследования
Район исследования. Работа выполнена в июле 2018 г. на приливно-отливной зоне западного побережья Белого моря от губы Лебяжьей до губы Керетской, которая представляет собой небольшой залив, являющийся эстуарием реки Кереть (рис. 1).

Рис. 1. Расположение пробных площадей (ПП1, ПП2, ПП3) в районе исследования
Исследования проходили на трех пробных площадках (ПП) методом маршрутных учетов в естественных границах растительности. ПП1 – губа Лебяжья (66,293005 °с.ш., 33,592337 °в.д.), у которой, согласно классификации И.П. Бреслиной (1980) [4], песчано-каменистый ряд характерен для крутых литоралей, не защищенных от волнобоя участков. Грунт несортированный песчаный с прослойками камней, характеризуется подвижностью. Береговая полоса, формируемая приливной волной, ступенчато или валообразно приподнята над литоралью, характерен галечный песчано-глинистый субстрат, соотношение галька: песок: глина составляет 235/160/105. ПП2 – выход из губы Лебяжья (66,293000 °с.ш., 33,608432 °в.д.), супесчаный ряд характерен для обширных пологих литоралей, достаточно защищенных от волнобоя губ, представлен глинисто-песчаный субстрат с незначительной долей гальки – 31/220/239. ПП3 – вход в губу Керетскую (66,290796 °с.ш., 33,609796 ° в.д.) грунт литорали песчаный или каменисто-песчаный, слегка заиленный – 85/345/70. С геоботанической точки исследованные территории относятся к лугам низкого уровня [5].
В средней части каждой трансекты были отобраны пробы почв и растений на определение содержания тяжелых металлов. На расстоянии 2–3 м от линии уреза воды выполнено три прикопки почв вне растительного покрова, а также отобрано по 5 растений каждого вида с обязательным сбором прикорневого субстрата (для расчета КБП металлов).
Объекты исследования – растения галофиты, морская вода и грунты приливно-отливной зоны Белого моря. Галофиты – триостренник морской (Triglochin maritima L.) – циркумбореальный умеренно-арктический вид; подорожник морской (Plantago maritima L.) – гипоарктический евразиатский вид [1]. Оба вида распространены на всей исследуемой территории (рис. 2–3).
Определение солености воды в полевых условиях проводили рефрактометром. Степень засоленности почв оценивалась по массовой доле ( %) сухого (плотного) остатка водной вытяжки, содержание органического вещества определяли по методу Тюрина [6]. Анализ выполнялся на базе факультета почвоведения Московского государственного университета им М.В. Ломоносова.

Рис. 2. Триостренник морской Triglochin maritima L.

Рис. 3. Подорожник морской Plantago maritima L.
Содержание тяжелых металлов определяли атомно-эмиссионным, атомно-абсорционным методом (атомно-абсорбционный спектрофотометр АА-7000 (Shimadzu, Япония) на научном оборудовании Центра коллективного пользования Федерального исследовательского центра «Карельский научный центр Российской академии наук». В работе представлены валовые средние арифметические значения содержания тяжелых металлов в грунтах, корнях, листьях, целом растении и морской воде.
Коэффициент биологического поглощения (КБП) металлов характеризует способность растений поглощать тяжелые металлы из среды, рассчитывали как отношение содержания металла в растении к его содержанию в среде (грунт + вода). Грунт отбирали непосредственно в зоне корней растений. Растения триостренника и подорожника делили на подземную часть (корни) и надземную часть (листья + стебли + соцветия). Рассчитывали значения КБП металлов всем растением, в корнях и надземной части на каждой пробной площади и в среднем по пробным площадям (ПП).
Статистическая обработка данных. Достоверность полученных результатов оценивали с помощью критерия Стьюдента, с учетом объема сравниваемых совокупностей и порога доверительной вероятности 0,95 (программа Statgraphics 2.1 для Windows).
Результаты исследования и их обсуждение
На всех пробных площадках было исследовано содержание тяжелых металлов у двух видов растений триостренника морского (Triglochin maritima) и подорожника морского (Plantago maritima), а также в морской воде и литоральном грунте зоны корней растений.
Содержание тяжелых металлов в грунтах и морской воде исследуемой территории
Содержание железа в грунте в районе исследования было в среднем 12359 ± 3525 мг/кг, максимально в грунте ПП1 (губа Лебяжья) – 16131 мг/кг, минимально на ПП2 (выход из губы Лебяжья) – 9149 мг/кг. Марганец был представлен в грунтах на уровне 122,80 ± 25 мг/кг, максимально на ПП1 – 143,14 мг/кг. Количество цинка установлено в среднем на уровне 15,50 ± 3 мг/кг, минимальное количество цинка было в грунтах ПП2 – 11,60 мг/кг. Содержание меди в среднем было на уровне 13,34 ± 10 мг/кг в грунтах исследуемой территории и максимально на ПП1 – 24,50 мг/кг. Никель был установлен в среднем в количестве 9,73 ± 3 мг/кг, максимально на ПП3 (вход в Керетскую губу) – 12,71 мг/кг. И содержание свинца было установлено на уровне 2,50 ± 1 мг/кг в среднем на всех пробных площадях, минимально в грунте ПП1 – 1,57 мг/кг (табл. 1). Грунт губы Лебяжьей является среднезасоленным (1,9 %), несколько меньше засоление на выходе из губы Лебяжьей (1,1 %), а участок на входе в губу Керетскую слабозасолен (0,6 %). Содержание органического вещества в губе Лебяжьей составило 0,8 %, на двух других – 0,4 %. Литоральный грунт на всех пробных имел слабокислую реакцию – 3,48–4,06. Определение обменной кислотности показало, что практически везде происходит нивелирование разницы между водным и солевым рН.
Таблица 1
Содержание металлов (S – среднее арифметическое значение, m – стандартное отклонение, min – минимальное, max – максимальное значения) в грунтах пробных площадей литорали Белого моря
|
Металл |
ПП1 |
ПП2 |
ПП3 |
S |
m |
min |
max |
Кларк* почвы |
Фон** донные отложения |
ОДК** донные отложения |
|
мг/кг |
||||||||||
|
Fe |
16131 |
9149 |
11794 |
12359 |
3525 |
6452 |
18684 |
– |
– |
46500 |
|
Mn |
143,14 |
94,44 |
130,81 |
122,80 |
25 |
55,70 |
191,90 |
850 |
– |
1500 |
|
Zn |
17,25 |
11,60 |
17,65 |
15,50 |
3 |
8,60 |
25,30 |
50 |
150 |
150 |
|
Cu |
24,54 |
6,90 |
8,57 |
13,34 |
10 |
4,97 |
14,93 |
20 |
35 |
35 |
|
Ni |
9,89 |
6,59 |
12,71 |
9,73 |
3 |
5,07 |
20,11 |
40 |
30 |
30 |
|
Pb |
1,57 |
3,10 |
2,81 |
2,50 |
1 |
0,89 |
4,44 |
10 |
30 |
30 |
Примечание. *Кларк тяжелых металлов в почвах мира [7].
**Фоновые значения содержания тяжелых металлов в донных отложениях (ДО) морей [8].
**ОДК – ориентировочно допустимые концентрации для незагрязненных донных осадков по SFT для Zn, Cu, Ni и Pb, ссылка из [9].
Таким образом, содержание тяжелых металлов в грунтах пробных площадей не превышало ОДК (ДО) и было ниже кларковых (почва) и фоновых значений (ДО). Грунты исследуемой территории средне-слабозасоленные, слабокислые, бедные с наибольшим содержанием большей части исследуемых металлов на ПП1 – губа Лебяжья.
Морская вода в районе пробных площадей отличается соленостью и связанной с ней содержанием хлорид-ионов и минерализацией. Вода ПП1 (губа Лебяжья) имеет самые высокие соленость – 15 ‰, содержание хлорид-ионов 5 г/л и минерализацию – 13,46 г/л. Вода ПП2 (выход из губы Лебяжья) имеет соленость 7 ‰, соответственно 3,46 г/л и 18,08 г/л – содержание хлорид ионов и минерализацию. И вода ПП3 (вход в Керетскую губу) характеризуется солёностью 0 ‰, содержание хлорид-ионов – 0,56 г/л и минерализация 1,14 г/л, что связано с наличием выходов пресной воды (табл. 2).
Таблица 2
Содержание элементов (S – среднее арифметическое значение, m – стандартное отклонение) в морской воде в районе пробных площадей литорали Белого моря
|
Показатель |
ПП1 |
ПП2 |
ПП3 |
S |
m |
Фон* |
ПДК** морская вода |
|
NO3-, мг/л |
34,43 |
30,95 |
7,81 |
24,39 |
14,47 |
– |
39 |
|
Cl-, г/л |
5,00 |
3,46 |
0,56 |
3,01 |
2,25 |
> 2,5 |
– |
|
Сорг, мг/л |
29,19 |
18,08 |
46,00 |
31,09 |
14,05 |
– |
– |
|
Минерализация, г/л |
13,46 |
12,48 |
1,14 |
9,03 |
6,85 |
– |
– |
|
Fe, мг/л |
0,1621 |
0,1396 |
0,2769 |
0,1929 |
0,074 |
0,01 |
0,05 |
|
Mn, мг/л |
0,0074 |
0,0149 |
0,0201 |
0,0141 |
0,006 |
0,002 |
0,05 |
|
Zn, мг/л |
0,0029 |
0,0032 |
0,0047 |
0,0036 |
0,001 |
0,01 |
0,05 |
|
Ni, мг/л |
1,3576 |
0,2871 |
0,0017 |
0,5488 |
0,715 |
0,002 |
0,01 |
|
Cu, мг/л |
0,0017 |
0,0016 |
0,0020 |
0,0018 |
0,000 |
0,03 |
0,005 |
|
Co, мг/л |
0,0008 |
0,0255 |
0,0003 |
0,0088 |
0,014 |
0,0005 |
0,005 |
|
Cr, мг/л |
0,0029 |
0,0011 |
0,0015 |
0,0018 |
0,001 |
0,0002 |
0,02–0,07 |
|
Al, мг/л |
0,0894 |
0,0591 |
0,0529 |
0,0671 |
0,020 |
0,01 |
0,04 |
|
Pb, мг/л |
0,0063 |
0,0046 |
0,0004 |
0,0038 |
0,003 |
0,00003 |
0,01 |
|
Cd, мг/л |
0,0001 |
0,0083 |
0,0001 |
0,0028 |
0,005 |
0,0001 |
0,01 |
|
Соленость, ‰ |
15 |
7 |
0 |
5–31 |
– |
– |
– |
Примечания: *Фон – естественный уровень исследуемых показателей морской воды [многочисленные источники].
** ПДК в морской воде водных объектов рыбохозяйственного значения [10].
Морская вода в районе исследования загрязнена железом (3,8 ПДК), никелем (55 ПДК), кобальтов (1,7 ПДК) и алюминием (1,7 ПДК) (табл. 2). Содержание кадмия, свинца, марганца и хрома в морской воде площадей превышает естественный фон содержания элементов морской воды, но ниже ПДК. А содержание цинка, меди низкое в воде, не превышает естественный фон элементов морской воды (табл. 2). Наиболее низкое содержание элементов морской воды зафиксировано на ПП2 – выход из Лебяжьей губы.
Накопление тяжелых металлов галофитами Triglochin maritimа и Plantago maritima
Железо. Нами установлено, что растения Triglochin maritimа накапливают железа почти в два раза больше, чем растения Plantago maritima, 22021 ± 11362 и 13351 ± 10378 мг/кг соответственно. Это довольно высокие уровни содержания железа у растений. При этом на ПП1 (губа Лебяжья) оба вида растений содержат железа в 1,5–3 раза больше, чем на других пробных площадях. КБП железа всем растением в среднем по пробным площадям у Triglochin maritimа равен 2,08, у Plantago maritima – 0,97. При этом средние значения КБП железа на пробных площадях в корне триостренника – 1,78, а в корне подорожника – 0,76. Надземные органы обоих видов растений слабо накапливают железо, все КБП меньше единицы и равны 0,30–0,21 (рис. 4).
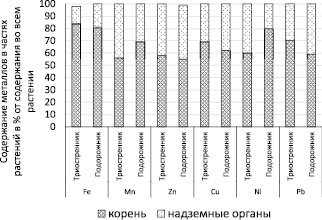
Рис. 4. Содержание тяжелых металлов в корне, надземных органах в % от общего содержания металлов во всем растении Triglochin maritimа и Plantago maritima (усредненные данные по ПП1-ПП3)
На рис. 4 представлено усредненное по пробным площадям содержание металлов в корнях и надземных органах растений в процентах от содержания металлов во всем растении.
Марганец. Оба вида галофита депонировали в среднем близкие количества марганца Triglochin maritimа 134,31 ± 27,75 и Plantago maritima 162,46 ± 30,65 мг/кг на всех площадях. Эти значения ниже критического уровня содержания марганца у растений (300–500 мг/кг). При этом марганец равномерно накапливался как надземными органами, так и корнями обоих видов растений (рис. 4). КБП марганца надземными органами были в диапазоне 0,2–0,8, КБП марганца корнями 0,6–1; при расчете на всё растение КБП у Triglochin maritimа и Plantago maritima близки и равны 1,31 и 1,21 соответственно. Это указывает на активное накопление марганца исследованными видами из среды обитания на всех пробных площадях.
Цинк. Растения Triglochin maritimа содержали цинка в два раза меньше, чем растения Plantago maritima 26,01 ± 4,63 и 42,68 ± 2,95 мг/кг соответственно. Это низкие уровни содержания металла у растений, критический уровень по цинку – больше 100 мг/кг. Оба вида растения активно накапливают цинк, средние значения КБП цинка по ПП всем растением больше единицы (1,84 у триостренника и 2,81 у подорожника). Цинк депонируется в основном в корнях галофитов (КБП 1,04 и 1,57), в надземной части растений накопления цинка меньше (КБП 0,80 и 1,23) (рис.4). Можно отметить, что на ПП2 (выход из губы Лебяжья) и Triglochin maritimа и Plantago maritima более интенсивно поглощают цинк, так как КБП цинка всем растением самые высокие и равны 2,52 и 3,35 соответственно.
Медь. Исследованные растения содержали меди ниже критического уровня у растений (20–100 мг/кг): 14,35 ± 2,70 у Triglochin maritimа и 21,16 ± 2,23 у Plantago maritima мг/кг. Оба вида растения активно накапливают медь, средние значения КБП меди по ПП всем растением больше единицы (1,91 у триостренника и 3,29 у подорожника). Металл медь активно депонировался и надземной частью растений (КБП меди равны 0,78–1,27), и корнями (КБП меди равны 1,13–2,02) обоих видов растений, но корнями в больших количествах (рис. 4). При этом вид Plantago maritima более активно поглощал медь, по сравнению с видом Triglochin maritimа и особенно на ПП3 – вход в губу Керетская (КБП меди целым растением 4,52).
Никель. В условиях литорали Белого моря вид Triglochin maritimа очень активно накапливал никель до значений 36,01 ± 6,71 мг/кг (критический уровень у растений по никелю 10–100 мг/кг). Этот вид также имеет высокие средние КБП никеля всем растением по ПП – 3,42. Никель равномерно распределяется по растению Triglochin maritimа (КБП над. органы 1,44, КБП корня 1,98, КБП всего растения 3,42) (рис. 4). Вид Plantago maritima содержит никеля в два раза меньше 15,61 ± 7,07 мг/кг и КБП никеля всем растением ниже, чем у Triglochin maritimа – в среднем по ПП – 1,57. В корнях Plantago maritima никель накапливается активнее, чем в листьях, стеблях и соцветиях (КБП корня 1,23, а КБП надзем. органы 0,34) (рис. 4).
Свинец. Растения Triglochin maritimа накапливали 2,88 ± 0,31 мг/кг и растения Plantago maritima 3,25 ± 0,01 мг/кг свинца, что не превышает критические уровни для растений (5–30 мг/кг). Оба вида галофитов активно депонировали свинец, КБП свинца всем растением в среднем по ПП равны у триостренника 1,51, у подорожника – 1,30. Можно отметить, что свинец накапливался и в надземных органах, и в корнях галофитов (рис. 4) и КБП свинца надзем. части равны 0,11–0,97; КБП свинца корнями 0,59–1,20 – очень варьировали в зависимости от пробной площади и вида растений.
Таким образом, все исследуемые металлы активно накапливаются галофитами Triglochin maritimа и Plantago maritima (КБП > 1).
Полученные данные свидетельствуют о том, что литоральные грунты приморских территорий Белого моря (п. Кереть, Республика Карелия) песчаные или каменисто–песчаные, средне-, и слабозасоленные, бедные по содержанию органических веществ, марганца, цинка, никеля, свинца, и содержат фоновые количества железа и меди, то есть не загрязнены тяжелыми металлами. Морская вода значительно загрязнена железом (3,8 ПДК) и никелем (55 ПДК), бедна цинком, медью и характеризуется фоновым уровнем свинца и марганца. При этом наибольшее содержание большей части исследуемых металлов установлено на ПП1 – губа Лебяжья. Возможно, это связано с тем, что Губа Лебяжья – частично закрытая губа от основной акватории Белого моря, поэтому в ней накапливается большая часть загрязняющих веществ.
Согласно исследованиям Ильина с соавторами (2015) [9] поступление загрязняющих веществ в Белое море происходит со стоковыми течениями крупных рек (Онега, Северная Двина). Через устьевые участки рек в прибрежную зону моря сбрасывается около 250,5 млн м3 сточных вод. Зонами аккумуляции поллютантов становятся Онежский, Двинской, Кандалакшский и Мезенский заливы и центральная глубоководная область моря – бассейн с замкнутой системой циркуляции вод. Сброс поверхностных и коммунальных стоков формирует в заливах устойчиво повышенный уровень концентраций железа и молибдена (до 2 ПДК), эпизодически – меди [9]. Протяженность береговой линии Белого моря в пределах Республики Карелия свыше 850 км. Гидрологический и гидрохимический режимы моря складываются под воздействием значительного материкового стока (свыше 200 км3 в год) и водообмена с Баренцевым морем (средний расход стокового течения равен 2200 км3 в год). В воды Белого моря на территории Карелии впадают четыре крупных реки (Кемь, Нижний Выг, Верхний Выг, Кереть). Объем сбрасываемых карельских сточных вод в поверхностные водные объекты бассейна Белого моря в 2017 г. составил 76,18 млн м3, в том числе 18,87 млн м3 приходится на стоки хвостохранилища АО «Карельский окатыш» [11]. Основные загрязняющие вещества в воде хвостохранилища АО «Карельский окатыш» – никель (0,017–0,025 мг/л), марганец (0,432–0,650 мг/л) и цинк (0,051–0,075 мг/л), а техногенном субстрате комбината – железо (39505–45120 мг/кг) [12]. Именно значительная аккумуляция тяжелых металлов никеля и железа была нами установлена в морской воде Лебяжьей и Керетской губ. Также наибольшую массу в составе загрязняющих веществ, сбрасываемых в водоемы бассейна Белого моря, составляют: марганец (2493 кг), магний (524357 кг), нитриты (8534 кг), взвешенные вещества (425 т), сульфаты (12602 т), фенолы (487 кг) [11].
Галофиты литорали Triglochin maritimа и Plantago maritima активно накапливают всем растением Fe, Mn, Ni,Cu, Zn, Pb, все КБП металлов > 1, корнями больше (50–70 % от общего содержания элемента в растении), чем надземными органами (30–50 %), за исключением железа. 80 % всего железа в растении накапливается в корнях. Это связано с тем, что оба вида галофитов – многолетники, у которых сохраняются длительное время хорошо развитые подземные органы [1].
Однако считается, что, несмотря на существенную изменчивость в способности различных растений к накоплению тяжелых металлов, аккумуляция элементов имеет определенную тенденцию. По степени накопления выделяется несколько групп элементов: 1) Zn, Cu, Pb – имеют среднюю степень поглощения, 2) Mn, Ni – слабо поглощаются и 3) Fe – труднодоступен растениям [13]. Ранее нами также показано, что в условиях техногенных ландшафтов железо, никель очень слабо накапливаются ивами-фиторемедиантами (КБП < 1) [12].
Триостренник морской Triglochin maritimа имеет следующий ряд накопления металлов (в расчете на всё растение, в среднем по ПП1–ПП3): Ni (3,42) > Fe (2,08) > Cu (1,91) > Zn (1,84) > Pb (1,51) > Mn (1,31). А подорожник морской Plantago maritima: Cu (3,29) > Zn (2,81) > Ni (1,57) > Pb (1,30) > Mn (1,21) > Fe (0,97). Поэтому виды галофиты Triglochin maritimа и Plantago maritima можно отнести к аккумуляторам тяжелых металлов в условиях литорали Белого моря.
Согласно современным представлениям, галофиты отличаются высокой устойчивостью к токсическому действию тяжелых металлов, способны как активно поглощать металлы из среды, так и выводить их из своих органов, снижая негативное действие поллютантов. У галофитов предполагается наличие физиолого-биохимических и молекулярных механизмов кросс-устойчивости к совместному действию солей и тяжелых металлов. В обзоре Van Osten с соавторами (2015) [13] из Университета Колорадо рассматриваются фиторемедиационная способность некоторых видов галофитов, механизмы детоксикации поллютантов. Например, виды рода Spartina (сем. Мятликовые) способны выводить токсические металлы Cr, Pb, Zn и Hg в кристаллах соли через солевые железы [14]. Показано, что некоторые галофиты адаптируются к окислительному стрессу, вызванному Cu, Cd и Pb, за счет снижения уровня АБК, синтеза фитохелатинов, который коррелирует с концентрацией хлорида натрия в среде [15]. Галофиты приморских территорий, солоноватых болот и скал Armeria maritima, Atriplex halimus Atriplex nummularia, Halimione portulacoides, Limoniastrum monopetalum, Mesembryanthemum crystallinum, Salicornia brachiate, Sarcocornia perennis, Sedum plumbizincicola, Sesuvium portulacastrum рассматриваются как виды устойчивые к действию тяжелых металлов и гипераккумуляторы последних [13].
Заключение
Литораль Белого моря – зона контакта моря и суши, подвергается негативному антропогенному воздействию, в том числе и в местах обитания доминантных видов галофитов – подорожника морского (Plantago maritima L.) и триостренника морского (Triglochin maritimа L.). Эти виды активно накапливают тяжелые металлы и могут рассматриваться как фиторемедианты приморских территорий.
Библиографическая ссылка
Теребова Е.Н., Марковская Е.Ф., Орешникова Н.В., Таскина К.Б., Андросова В.И. НАКОПЛЕНИЕ ТЯЖЕЛЫХ МЕТАЛЛОВ В ГРУНТАХ И ГАЛОФИТАХ ЛИТОРАЛИ БЕЛОГО МОРЯ // Успехи современного естествознания. 2019. № 12-1. С. 162-169;URL: https://natural-sciences.ru/ru/article/view?id=37284 (дата обращения: 04.02.2026).



