Полярная морская среда уникальна, она предоставляет холодную соленую воду для питания термохалинной циркуляции и переноса неорганического и органического углерода в глубокий океан. Температура вод Южного океана никогда не превышает 4 °C [1]. Однако, в отличие от глубокого океана, полярная морская среда подвергается экстремальным сезонным колебаниям, которые связаны с морским ледяным покровом, освещенностью и продолжительностью дня (рис. 1).
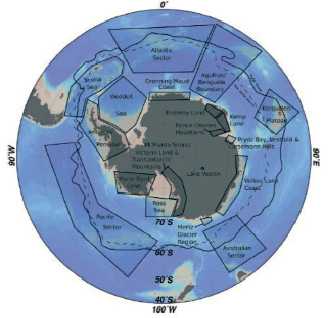
Рис. 1. Антарктида и Южный океан. Полярный фронт (циркумполярный – сплошная линия); максимальная протяженность морского льда (циркумполярная – пунктирная линия). Регионы Антарктиды показаны с озерами [2]
Южный океан играет решающую роль в глобальном круговороте углерода, осуществляя контроль концентрации CO2 в атмосфере, отсюда возникает необходимость понимания роли биоты в регуляции углеродного цикла. Оценка вертикального распределения растворенного метана в водах Южного океана, показала, что поверхностный слой гораздо насыщенней, чем расположенный ниже слой, богатый хлорофиллом, что позволяет предположить, что существует связь между концентрацией CH4 и динамикой роста и развития планктона [3]. Считается, что как алифатические, так и ароматические углеводороды, присутствующие в Южном океане, прежде всего, имеют биогенную природу и могут рассматриваться как часть естественного фона. Южный океан – большая и гетерогенная биогеохимическая система [4]. В прибрежных районах в весенний и летний периоды происходит интенсивное цветение фитопланктона, который является начальным звеном пищевой цепи. Напротив, открытый океан – это наибольший район с высоким содержанием питательных веществ и низким содержанием хлорофилла, характеризующаяся минимальной первичной продукцией, в основном ограниченной низким содержанием железа в водах Южного океана [2]. Пространственное распределение бактериопланктона и деградация органических веществ в основном связаны с гидрологическими и трофическими условиями. Благодаря скорости метаболизма микроорганизмы проявляли себя в качестве регуляторов переноса органического углерода в Южном океане и оказывали влияние на биогеохимические циклы Антарктики [5].
С точки зрения биомассы в открытом океане доминируют бактерии и археи. Они играют важную роль в регулировании, накоплении, экспорте, реминерализации и преобразовании крупнейшего в мире пула органического углерода [3]. Бактерии составляют до 90 % клеточной ДНК, 40 % углерода в планктоне, до 80 % первичной продукции и способны окислять питательные вещества примерно в 100 раз быстрее, чем эукариотический фитопланктон.
Микробные пищевые цепи развиваются даже в тех районах Южного океана, где много крупных Euphausiacea. Эти трофические пути с множественными уровнями включают мелких многоклеточных, которые преобладают в северных открытых водах [6] (Copepoda, Chaetognatha, Amphipoda, Myctophidae, рыбы и птицы) в отличие от классической короткой цепочки: диатомеи – криль – позвоночные. Биоразнообразие морских прокариот зависит от времени, места и метода отбора проб. Экологические геномные исследования в Южном океане, направленные на выявление организмов и метаболических возможностей микробного сообщества, находятся в начальной стадии своего развития. Гризимски с соавторами (2012) обнаружили, что наиболее заметным изменением бактериопланктонного сообщества в прибрежных поверхностных водах Антарктического полуострова было присутствие хемолитоавтотрофных организмов зимой и их фактическое отсутствие летом, когда падающее солнечное излучение достигает максимума и показатели первичной продукции высоки. Если хемолитоавтотрофия широко распространена зимой в Южном океане, то этот процесс может быть ранее неизвестным стоком углерода [3, 7].
Исходя из этого, целью научного обзора литературы было описание молекулярно-гентического и функционального биоразнообразия бактерий и их роли в углеродном цикле в водах Южного океана.
Бактериопланктон играет жизненно важную роль в экологии и экосистемах Южного океана. Тем не менее филогенетическое разнообразие, геномный анализ функциональной структуры и метагеномные исследования антрактических вод является достаточно обрывочными. Структура и численность сообщества бактериопланктона существенно сдвигается в течение годового цикла по мере таяния морского льда и цветение фитопланктона. Филогенетические группы антарктического бактериопланктона, такие как морская группа I Crenarchaeota, Alphaproteobacteria (относящиеся к Roseobacter и кластеры SAR-11), Gammaproteobacteria (как культивируемые, так и некультивированные) и Bacteriodetes-подобные бактерии в Южной океане являются общими с другими океаническими системами (рис. 2). Однако, кроме этого, встречается большое разнообразие видов уникальных для этого региона [8].
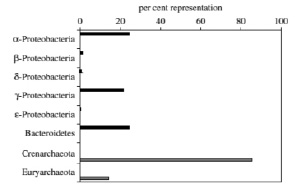
Рис. 2. Распределение бактериальных и архейных филогенетических групп на основе последовательностей рДНК SSU, полученной из морской воды в середине октября 2001 г.: бактерии (черные столбцы) и археи (серые столбцы) [7]
Alphaproteobacteria: SAR11
Pelagibacterales (SAR11) являются отделом Alphaproteobacteria. SAR11 неоппортунистическим олиготрофными микроорганизмами и с наибольшей интенсивностью разлагают растворенное органическое вещество в низких концентрациях. При увеличении содержания органики, например, при цветении фитопланктона, рост и развития этого типа бактерий угнетается. SAR11 доминирующая группа прокариот, широко распространенная не только в эпипелагической зоне, но и на глубине [9].
Интересной физиологической особенностью SAR11 является экспрессия ретинальсвязывающего пигмента протеородопсина, который функционирует в качестве протонного насоса при воздействии света и участвует в фотогетеротрофии, поэтому, несмотря на очень низкий уровень освещенности в водах Антарктики во время австралийской зимы, в метапротеоме протеородопсин фиксируется на протяжении всего годового цикла [10].
Alphaproteobacteria: Roseobacter
Roseobacter представлен в большинстве морских поверхностных вод и обладает широкой экологической пластичностью. Roseobacter способен к аэробной аноксигенной фототрофии, деградации диметилсульфониолпропионата по меньшей мере двумя путями, окислению монооксида углерода, использованию широкого спектра простых органических субстратов. Данные микроорганизмы могут быть как свободноживущими, так и симбионтами многоклеточных. Эти характеристики отражаются в широком разнообразии геномных черт, которые демонстрируются родственными членами группы Roseobacter [10].
Некоторые исследователи на основе генов 16S рРНК выделяют подгруппу Roseobacter Clade Affiliated (RCA), которая широко распространена как в поверхностных водах Южного океана, так и на глубине до 2200 м. RCA разделена на две основных группы: субантарктическую и антрактическую. Филотипы строго разделены полярным фронтом и сосуществуют только в полярной фронтальной зоне, где они могут превосходить по численности даже SAR11. Есть некоторые доказательства того, что филотип RCA происходит из антарктической зоны Северной Атлантики. В Южном океане вертикальные профили изобилия RCA имеют прочные экологические связи с фитопланктоном [11].
Численность RCA имеет сезонную динамику. Метагеномное исследование вод Южного океана около Западной Антарктиды позволило выявить, что гены 16S рРНК Roseobacter были более распространены летом, чем зимой [12].
Alphaproteobacteria: SAR116
Alphaproteobacteria SAR116 широко распространены по всему мировому океану. В молекулярных исследованиях Южного океана, данный тип в наибольшей степени наблюдался в субантарктической зоне, чем в антарктической [7]. Они участвуют в цикле углерода и способны фиксировать метан. Бактерии SAR116 в одинаковой степени были обнаружены как в летний, так и зимний период.
Betaproteobacteria
Betaproteobacteria – выполняют значительную экологическую функции, в частности участвуют в цикле азота и метана. Впервые они были обнаружены в поверхностных водах моря Росса [10]. Метагеномный и метапротеомный анализ поверхностных прибрежных вод Антрактического полуострова позволил выявить ведущую роль Betaproteobacteria в цикле Кальвина и окисление аммиака в зимний период [13, 14].
Betaproteobacteria: SAR86
SAR86 является наиболее часто встречающимся некультивируемым типом микроорганизмов в Южном океане [14]. Клетки SAR86 составляли от 8 % до 18 % от общей численности бактериопланктона поверхностных вод. Данный тип специализируется на утилизации липидов и углеводов. Эти функциональные различия предполагают минимальную конкуренцию между SAR86и SAR11, поэтому оба типа характеризуются высокой численностью в водах субантарктической зоны [15].
Gammaproteobacteria: GSO-EOSA-1
GSO-EOSA-1 – это группа сульфатредуцирующих микроорганизмов, которая включает в себя некультивируемые линии ARCTIC96BD-19 и SUP05 и культивируемых хемоавтотрофных симбионтов моллюсков, которые были обнаружены в мезопелагических водах и зоне минимума кислорода. GSO-EOSA-1, по-видимому, филогенетически связан с Thiotrichales [16]. SUP05 способны участвовать в фиксации углерода с использованием цикла Кальвина и в окислении серы даже в хорошо насыщенных кислородом водах.
Различные другие группы прокариот, относящиеся к Gammaproteobacteria (например, Oceanospirillales, Alteromonadales) были обнаружены в водах Южного океана, в том числе Neptuniibacter caesariensis, Marinomonas spp., Marinobacter aquaeolei, Colwellia psychrerythraea и Pseudoalteromonas haloplanktis [16, 17]. Это подвижные хемоорганотрофы, которые способны использовать в качестве источника углерода простые сахара, аминокислоты, органические кислоты или (в случае M. aquaeolei) углеводороды [18, 19].
Deltaproteobacteria: SAR324
Deltaproteobacteria в основном распространены на глубинах около 3000 м. SAR324 участвует в фиксации углерода через цикл Кальвина и окисления серы, а также способен к разложению метилированных соединений [20].
CFB (Cytophaga-Flavibacterium-Bacteroides)
Группа CFB является космополитической и широко распространенной в мировом океане. Flavobacteria часто образуют основную фракцию планктона в Южном океане [21]. Они играют важную роль в реминерализации первичной продукции. Flavobacteria в Южном океане имеют ярко выраженное биогеографическое распределение. Разнообразие Flavobacteria, к югу от полярного фронта, значительно выше, чем в субантарктике [22]. Крупномасштабный метагеномный анализ, который определил полярный фронт как основную биогеографическую границу, обнаружил, что CFB обладала большей численностью к югу от него. Эта разница в численности может быть в значительной степени обусловлена доступностью железа [23].
Другие филогенетические группы бактерий, обнаруженные в Южном океане
Verrucomicrobia – недавно описанный бактериальный тип, повсеместно распространенный в морской среде и, по-видимому, состоит из нескольких физиологически различных групп. Небольшое количество представителей данного типа Verrucomicrobia были обнаружены в Южном океане. Наибольшее количество OTU для Verrucomicrobium Coraliomargarita akajimensis было обнаружено в антарктической зоне, по сравнению с водами субантарктики [24].
Существуют единичные случаи наблюдения бактерий типа Planctomycetes и Actinobacteria в глубинных и прибрежных водах Южного океана [25]. Planctomycetes участвуют в анаэробном окислении аммиака [26].
Archaea
Большинство бактерий, относящихся к археям и обитающих в антарктических водах, были связаны с морской группой I Crenarchaeota (MGI; также называется Thaumarchaeota), в то время как остальная часть представляла группу II Euryarchaeota [27, 28]. Последующие анализы рРНК подтвердили, что MGI являются наиболее распространенной группой архей, встречающихся в поверхностных водах Южного океана и прибрежных водах Антарктиды, за ней по численности следует группа II Euryarchaeota. Дальнейшие исследования продемонстрировали широкое распространение морских архей в продольном и северном и южном направлениях полярного фронта [7]. Archaea включая MGI, также были обнаружены в донных отложениях и на побережье Антарктики. В Южном океане численность архей снижается в течение весны и лета и отрицательно коррелирует с концентрацией хлорофилла. Аммиакокисляющие MGI были особенно чувствительными к фотоингибированию. Морская группа II Euryarchaeota была обнаружена в большей степени в поверхностных водах, чем на глубине [29].
Заключение
В бактериопланктоне в поверхностных водах Южного океана, который окружает Антарктиду, доминирует Alphaproteobacteria, Gammaproteobacteria, Flavobacteria, и MGI. Alphaproteobacteria состоят в основном из SAR11 и Roseobacter. SAR11 являются олиготрофами и разлагают простые органические субстраты. В то время как Flavobacteria специализируется на сложных субстратах. Gammaproteobacteria обладают разнообразными метаболическими возможностями. В их состав входит группа GSO-EOSA-1, которая играет важную роль в темновой фиксации углерода. Распространение и роль аммиакокисляющей группы архей MGI связывают с длительными периодами минимальной освещенности в течение долгой полярной зимы, также они вносят основной вклад в углеродную фиксацию в этот сезон. Многие таксоны, присутствующие в Южном океане, встречается в умеренных или тропических водах, при этом накопление данных метагенома позволяет выделить различия внутри филума SAR11. Метагеномика также позволяет выявить биогеографические различия между зонами Южного океана, например таких как полярный фронт. Объединенный метагеном / метапротеом анализ показывает, как абиотические и биотические факторы (например, фитопланктон цветение и сезонные изменения) влияют на состав и функции сообществ. В связи с применением функциональных омических подходов (метагеномика, метапротеомика, метатранскриптомика), в следующие 10 лет будут достигнуты новые успехи в изучении микробных сообществ Южного океана.
Работа выполнена в рамках госбюджетной темы «Комплексные исследования окружающей среды Южного океана», рег. номер FWMM-2019-0007.
Библиографическая ссылка
Пономарева А.Л., Бакунина М.С., Еськова А.И., Дубовчук С.С., Шакиров Р.Б., Обжиров А.И. РОЛЬ РАЗНООБРАЗИЯ ПРИРОДНЫХ МИКРОБНЫХ СООБЩЕСТВ В ЦИКЛЕ УГЛЕРОДА В ВОДАХ ЮЖНОГО ОКЕАНА // Успехи современного естествознания. 2019. № 12-2. С. 353-358;URL: https://natural-sciences.ru/ru/article/view?id=37313 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/use.37313



