Развитие одного из направлений координационной химии, направленное на синтез и изучение комплексов бора, является актуальным. Особое значение имеют экологически безопасные соединения, обладающие антимикробными свойствами. Возникает необходимость в синтезе и изучении физико-химических свойств соединений, относящихся к ацидокомплексам бора, как перспективным препаратам, обладающим достаточно большим спектром биоцидной и фунгицидной активности. Сравнительный анализ строения и свойств известных и новых биокоординационных веществ позволит выявить взаимосвязь между их строением и изменениями физико-химических свойств с целью дальнейшего использования комплексных соединений в различных областях. Комплексы на основе тетракоординированного бора образуют группу препаратов, обладающих довольно выраженными антимикробными действиями [1; 2]. В работе представлена усовершенствованная методика получения дилимонноборной кислоты и ее соли дицитратобората гуанидиния (ДЦБГ), данные по электропроводности, физико-химическим свойствам, строению кристаллов, а также рассчитаны константы нестойкости изучаемых соединений.
Цель исследования: используя кондуктометрический метод, определить удельную и молярную электропроводность кристаллов дилимонноборной кислоты и дицитратобората гуанидиния. На основании фотометрических измерений рассчитать константы нестойкости комплексных соединений, сделать вывод о влиянии внешней сферы на процесс диссоциации дилимонноборной кислоты и дицитратобората гуанидиния.
Материалы и методы исследования
Для получения дицитратобората гуанидиния использовали реактивы: борная кислота «ХЧ», лимонная кислота безводная «ЧДА», гуанидин гидрохлорид ХЧ (содержание основного вещества 94,3 %). Методика синтеза дицитратобората гуанидиния из смеси дилимонноборной кислоты и гуанидина гидрохлорида подробно описана в [3]. Авторами предложены изменения в разработанной схеме синтеза, позволяющие повысить выход продукта. В частности, при синтезе дилимонноборной кислоты температура водяной бани должна быть 65 °С, перемешивание системы проводится постоянно в течение 12 часов, т.к. перемешивание выравнивает концентрацию раствора у разных граней кристалла, что способствует приобретению ими более правильной формы. После 12 часов перемешивание прекращается, температура понижается постепенно, процесс кристаллизации проходит в течение суток. При получении комплексной соли ДЦБГ процесс растворения дилимонноборной кислоты проходит при температуре водяной бани 55 °С также при постоянном перемешивании системы. Рекомендовано гуанидин гидрохлорид вносить мелкими порциями, соблюдая промежуток времени не менее 10 минут между вносимыми порциями реагента. Процесс кристаллообразования начинается на вторые сутки, полностью формирование осадка происходит через 5 дней. Снижение температуры должно быть медленным и постепенным. Уравнение происходящей в системе реакции:
H3BO3 + 2C6H8O7 → Н[B(C6H6O7)2] + 3Н2О,
Н[B(C6H6O7)2] + CH6N3+ → CH6N3[B(C6H6O7)2] + H+.
Изучение кристаллов дилимонноборной кислоты и дицитратобората гуанидиния было выполнено с использованием поляризационного микроскопа ZEISS AXIO Scope A1 в проходящем свете в иммерсионных каплях диаметром до 10 мм. Фотографирование производилось на этом же микроскопе по программе Axio Vision Rel 4.8. Электропроводность водных растворов соли дицитратобората гуанидиния и дилимонноборной кислоты определяли с помощью кондуктометра К1-4 УПК УПИ при рабочей частоте 1 кГц с использованием кондуктометрической ячейки УК – 02/1 по методике [4]. Оптическую плотность растворов измеряли при помощи концентрационного фотоэлектрического фотометра КФК-3-01 (ЗОМЗ), толщина стенки кюветы 0,5 см, диапазон волн составил 315–650 нм.
Результаты исследования и их обсуждение
В кристаллическом состоянии дилимонноборная кислота существует в системе борная кислота – лимонная кислота – вода при 25 °С. Она является единственным комплексным соединением, кристаллизующимся в данных условиях, что подтверждается потенциометрическим титрованием дицитратобората калия раствором щелочи и рассчитываемым значением константы нестойкости. Дилимонноборная кислота представляет собой игольчатые кристаллы, устойчивые на воздухе, растворимые в воде, этиловом спирте, этилацетате; нерастворимые в бензоле, толуоле. Комплексная соль дилимонноборной кислоты дицитратоборат гуанидиния представляет собой пирамидальные белые кристаллы, устойчивые на воздухе, не растворимые в органических растворителях (рис. 1). Рост кристаллов ДЦБГ происходит за счет диффузионных потоков, образующих кристаллическую решетку, к которой частицы ацидокомплекса бора и гуанидина примыкают за счет диффузионного слоя жидкости из раствора к поверхности растущего кристалла. Затем происходит ориентированное сращивание достигших поверхности частиц в кристаллическую решетку. Таким образом, анализируя процессы кристаллообразования комплексных соединений, можно сделать вывод: рост кристаллов дилимонноборной кислоты и дицитратобората гуанидиния протекает по разным механизмам, отличается по скорости кристаллообразования и, как следствие, – по типам сформированных кристаллических структур. Объяснить подобное отличие можно различным строением внешней сферы комплексных соединений.


а) б)
Рис. 1. Кристаллы комплексных соединений: а) дилимонноборная кислота; б) дицитратоборат гуанидиния
Таблица 1
Удельные сопротивления растворов
|
№ раствора |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
*VA + VB, см3 |
8 + 2 |
7 + 3 |
6 + 4 |
5 + 5 |
4 + 6 |
3 + 7 |
2 + 8 |
|
R, Ом·м |
27 |
35 |
48 |
76 |
110 |
91 |
85 |
* VA – объем раствора дилимонноборной кислоты, VB – объем раствора гуанидина гидрохлорида.
Следующим этапом стало изучение физико-химических свойств дицитратобората гуанидиния и дилимонноборной кислоты. Для проведения кондуктометрических измерений готовили растворы с различным соотношением исходных компонентов (дилимонноборной кислоты и гуанидина гидрохлорида). Удельное сопротивление дистиллированной воды составило R = 10000 Ом·м. Постоянную ячейки устанавливали по 0,02 М раствору KCl, используя справочные данные, при температуре t = 25 °С (æ = 0,2765 См×м-1) [4], установили постоянную ячейки (K = 82,95 м-1). Общий объем смеси составил 10 см3, удельные сопротивления растворов представлены в табл. 1.
Используя стандартную методику [5], рассчитали удельную электрическую проводимость; результаты расчета показаны в табл. 2.
Таблица 2
Удельная электрическая проводимость растворов
|
№ п/п |
С, моль/л |
æ, См×м-1 |
|
|
Гуанидин гидрохлорид |
Дилимонноборная кислота |
||
|
1 |
0,10 |
0,48 |
3,070 |
|
2 |
0,15 |
0,42 |
2,370 |
|
3 |
0,20 |
0,36 |
1,7280 |
|
4 |
0,25 |
0,30 |
1,0914 |
|
5 |
0,30 |
0,24 |
0,7540 |
|
6 |
0,35 |
0,18 |
0,9115 |
|
7 |
0,4 |
0,12 |
0,9758 |
Исходя из полученных значений, рассчитали разницу между суммой удельных электрических компонентов и удельной электрической проводимости смесей, исходя из методики [6], по формуле Δk как: Δk = (kдилимонноборная кислота + kгуанидин) – kсмесь. Результат в табл. 3.
Таблица 3
Δκ для смесей исследуемых растворов
|
№ колбы |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Δκ |
-3,3126 |
-1,9265 |
-0,8195 |
0,0054 |
-0,9868 |
-0,2020 |
-0,2020 |
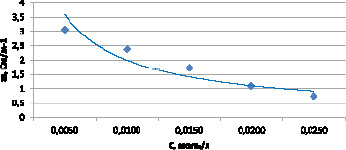
Рис. 2. Зависимость удельной электропроводности от концентрации смесей
Согласно полученным данным смесь № 4 максимально соответствует процессу образования комплексной соли дицитратобората гуанидиния, при этом соотношения компонентов будут 1:1. Таким образом, все дальнейшие измерения были проведены с образцом № 4. График зависимости концентраций смесей растворов и значения их удельной электропроводности показан на рис. 2.
Для проведения кондуктометрического исследования готовили растворы с концентрациями 0,1000; 0,0500; 0,0250; 0,0125 и 0,0060 моль/л. Задачей измерения стояло определение изменения электропроводности при соотношении компонентов 1:1, что характеризует максимальную способность к комплексообразованию исследуемых соединений. Предполагается, что дилимонноборная кислота и дицитратоборат гуанидиния должны диссоциировать по типу слабого электролита. Согласно предварительным данным дилимонноборная кислота должна являться более сильным электролитом, чем дицитратоборат гуанидиния. Для подтверждения данной гипотезы были обработаны данные по электропроводности. Начиная с самого разбавленного раствора, измеряли сопротивление комплексных соединений и рассчитывали их удельную и молярную электрическую проводимость (табл. 4).
Таблица 4
Молярная и удельная электропроводность
|
Дилимонноборная кислота |
|||||
|
№ |
1 |
2 |
3 |
4 |
5 |
|
C, моль/л |
0,1000 |
0,0500 |
0,0250 |
0,0125 |
0,0060 |
|
R, Ом |
470 |
470 |
440 |
570 |
240 |
|
æ, См/см |
0,0012 |
0,0016 |
0,0021 |
0,00320 |
0,0035 |
|
Ʌ, См*см2/моль |
12,0255 |
24,0511 |
51,3818 |
79,3263 |
392,5000 |
|
Дицитратоборат гуанидиния |
|||||
|
№ |
1 |
2 |
3 |
4 |
5 |
|
C, моль/л |
0,1000 |
0,0500 |
0,0250 |
0,0125 |
0,0060 |
|
R, Ом |
400 |
460 |
440 |
400 |
100 |
|
æ, См/см |
0,0009 |
0,0010 |
0,0013 |
0,0019 |
0,0024 |
|
Ʌ, См*см2/моль |
10,1300 |
14,5739 |
31,7818 |
53,0400 |
63,0000 |
Анализ полученных данных подтвердил, что дилимонноборная кислота является более сильным электролитом, чем ее соль ДЦБГ. Используя метод фотоколориметрии, рассчитали константы нестойкости изучаемых комплексных соединений. На первом этапе определили оптимальное соотношение исходных компонентов для получения дицитратобората гуанидиния. Для проведения спектрофотометрических измерений готовилось 11 образцов смесей растворов дилимонноборной кислоты и гуанидина гидрохлорида, общий объем смесей составил 10 см3. Максимум поглощения был зафиксирован при длине волны 320 нм, дальнейшие измерения проведены при данной длине волны, результаты показаны в табл. 5.
Таблица 5
Оптическая плотность смесей при λ = 320 нм
|
№ п/п |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
*VA + VB, см3 |
0/10 |
1/9 |
2/8 |
3/7 |
4/6 |
5/5 |
6/4 |
7/3 |
8/2 |
9/1 |
10/0 |
|
D изм, нм |
0,357 |
0,357 |
0,362 |
0,371 |
0,383 |
0,356 |
0,401 |
0,413 |
0,420 |
0,425 |
0,312 |
* VA – объем раствора дилимонноборной кислоты, VB – объем раствора гуанидина гидрохлорида.
На основании полученных данных по спектрофотометрии и основываясь на [5], рассчитали степень диссоциации дилимонноборной кислоты и константу нестойкости. Проведен сравнительный анализ полученного значения константы нестойкости дилимонноборной кислоты, как комплексного соединения с лимонной кислотой, константа нестойкости по первой ступени которой имеет значение К1 = 8,4´10-4. Анализ полученных данных позволил сделать вывод: дилимонноборная кислота является более сильным электролитом, т.к. константа нестойкости при 25 °С имеет значение К = 1•10-2. Следующим этапом определяли константу нестойкости комплексной соли дицитратобората гуанидиния. Зная значения оптической плотности и исходную концентрацию растворов, рассчитывают молярный коэффициент поглощения (kλ) для пробы № 1 и № 11. Используя формулу (1), вычисляют значение Dтер для каждой смеси.
Dтеор = (kλ,1∙C1 + kλ,2∙C2)∙d, (1)
где kλ – молярный коэффициент поглощения, дм2 /моль; С – молярная концентрация раствора, моль/дм3, d – толщина кюветы, дм.
По разнице между теоретическим значением оптической плотности при отсутствии в системе комплексного соединения дицитратобората гуанидиния и измеренными показателями оптической плотности с учетом мольного состава, определяют раствор, в котором максимально прошел процесс комплексообразования (проба № 6 с соотношением компонентов 1:1). Дальнейшие измерения и расчеты были проведены на основе пробы № 6. Вычисление степени диссоциации дицитратобората гуанидиния проводили по формуле (2), используя известное значение оптической плотности пробы.
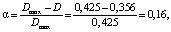 (2)
(2)
где Dmax – максимальная оптическая плотность, D – оптическая плотность, соответствующая процессу комплексообразования.
Константу нестойкости дицитратобората гуанидиния определяют по закону разбавления Оствальда (3)
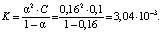 (3)
(3)
Расчет константы нестойкости дицитратобората гуанидиния проводился при температуре 25 °С. Согласно [7] рКа гуанидина гидрохлорида равно 11, т.е. протонированный ион гуанидиния, входящий во внешнюю сферу комплекса, проявляет очень слабые кислотные свойства, что сказывается на процессе диссоциации дицитратобората гуанидиния. Константа нестойкости дилимонноборной кислоты равна 1·10-2, константа нестойкости полученного комплексного соединения дицитратобората гуанидиния равна 3,04·10-3. На основании разницы значений констант нестойкости изучаемых комплексов можно сделать вывод о влиянии внешней сферы на электролитические свойства соединений. В частности, наличие катиона гуанидиния снижает скорость процесса диссоциации, что подтверждается разными значениями молярной и удельной электропроводности дилимонноборной кислоты и ДЦБГ.
Заключение
Внесены изменения в методику синтеза дицитратобората гуанидиния и дилимонноборной кислоты, что позволило увеличить выход продуктов по сравнению с ранее предложенным синтезом. Доказано, что постоянное перемешивание системы при формировании кристаллического осадка положительно влияет на структуру и рост кристаллов комплексных соединений, предотвращая распределение дефектов по зерну будущего кристалла. Проведено сравнение кристаллов изучаемых соединений, представлены их электронные фотографии. На фотографиях отчетливо видны различные формы кристаллических структур изучаемых соединений. Дилимонноборная кислота имеет игольчатую форму кристаллов, дицитратоборат гуанидиния представлен структурами в виде шестигранных пирамид. Анализируя полученные данные по удельной и молярной электропроводности комплексных соединений, можно сделать вывод, что дицитратоборат гуанидиния является более слабым электролитом по сравнению с дилимонноборной кислотой, что оказывает влияние на процесс диссоциации полученных комплексов. Изучение оптических свойств растворов данных соединений позволило рассчитать константы нестойкости, сравнить полученные данные и сделать вывод о влиянии внешней сферы комплекса на прочность связей внутренней сферы. Дилимонноборная кислота является более сильным электролитом, чем лимонная кислота и дицитратоборат гуанидиния. Дилимонноборная кислота и дицитратоборат гуанидиния могут быть использованы в качестве соединений, проявляющих антимикробную активность по отношению к грамположительным и грамотрицательным микроорганизмам, а также к некоторым плесневым грибам. Синтез данных соединений является простым и экологически безопасным. Разработка методики синтеза соединений, относящихся к группе ацидокомплексов бора, является перспективным направлением координационной химии, т.к. данные комплексные соединения могут иметь широкий спектр применения в различных областях.
Библиографическая ссылка
Кулешов Н.В., Тютрина С.В., Мясникова Н.В. ИЗУЧЕНИЕ ЭЛЕКТРИЧЕСКОЙ ПРОВОДИМОСТИ КРИСТАЛЛОВ ДИЦИТРАТОБОРАТА ГУАНИДИНИЯ // Успехи современного естествознания. 2021. № 8. С. 58-63;URL: https://natural-sciences.ru/ru/article/view?id=37671 (дата обращения: 12.02.2026).
DOI: https://doi.org/10.17513/use.37671



