Ежегодный мониторинг состояния водных объектов показывает, что в природных водах Тюменской области повышено содержание ионов меди (1,8 мг/л при ПДКCu = 1,0 мг/л) [1]. Медь является одним из самых подвижных металлов. Медь, взаимодействуя с неорганическими и органическими соединениями, способна образовывать комплексные соединения в водных растворах [2, 3]. Избыточное содержание ионов меди в воде представляет опасность для живых организмов. Медь занимает второе место в ряду самых токсичных тяжелых металлов после кадмия [2].
Высокая стоимость очищенной природной воды обусловливает необходимость поиска дешевых и эффективных материалов для водоочистки. В последние годы в связи с ограниченным количеством промышленных органических сорбентов для очистки природных и промышленных вод находят применение природные минеральные сорбенты [4, 5]. Природные сорбенты доступны, обладают высокой сорбционной способностью по отношению к тяжелым металлам, имеют низкую стоимость и устойчивы к воздействию агрессивной среды. Изучение состава диатомита позволит использовать его для очистки водных объектов от ионов тяжелых металлов, что является актуальным в настоящее время.
Целью работы является определение сорбционных характеристик природного диатомита по отношению к ионам меди.
Материалы и методы исследования
В работе использовали природный диатомит Ирбитского месторождения Свердловской области. Это месторождение признано самым крупным в России и Зауралье. Диатомит относится к опал-кристобалитовой породе. Основным минералом в нативной форме диатомита является монтмориллонит. Растровая электронная микроскопия проведена на электронном микроскопе JEOLJSM 6510 LV. В результате был определен химический состав диатомита (табл. 1).
На рисунке 1 представлен фазовый состав диатомита. Минералогический состав диатомита определяли рентгенофазовым анализом с помощью дифрактометра «ДРОН-7» с медным анодом (λ=1,5406 Å).
Химический анализ показывает, что диатомит на 80,11% состоит из диоксида кремния и на 9,18% – из оксида алюминия, что определяет кислый характер диатомита. Водорастворимые оксиды натрия и калия в его составе в сумме составляют 2,12%.
Химический (табл. 1) и фазовый состав (рис. 1) природного диатомита подтверждают наличие в нем 55% монтмориллонита, а общая доля глинистых минералов с учетом каолинита и хлоритов и гидрослюд составляет 82%. Монтмориллонит и хлориты имеют кристаллическую решетку моноклинной сингонии, которая подвижна за счет изменяющихся размеров микропор и расширяющейся элементарной ячейки [6, 7]. Расстояние между пакетами может изменяться от 0,4 до 2,0 нм, что обеспечивает легкость проникновения ионов в межпакетное пространство и увеличивает обменную емкость монтмориллонита.
Для изучения сорбции ионов меди брали 1 г диатомита и заливали 50 мл модельного раствора сульфата меди. В статических условиях использовали метод переменных концентраций (от 0,02 М до 012 М) и при температурах 298, 318, 333 К. Концентрацию ионов меди в растворах определяли по методике [8].
По полученным результатам была рассчитана обменная емкость по следующей формуле:
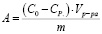 (1)
(1)
где А – обменная емкость, мг/г; C0 и Cp – начальная и равновесная концентрации ионов в растворе, ммоль/мл; Vp-pa – объем раствора, мл.
Таблица 1
Состав компонентов диатомита
|
Содержание |
SiO2 |
Al2O3 |
Na2O |
K2O |
CaO |
Fe2O3 |
TiO2 |
MgO |
|
% масс. |
80,11 |
9,18 |
0,286 |
1,83 |
0,703 |
4,90 |
0,814 |
0,983 |
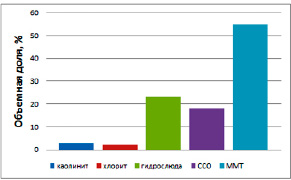
Рис. 1. Фазовый состав диатомита (ССО – смешанослоистый минерал; ММТ – монтмориллонит)
Результаты исследования и их обсуждение
Эффективность очистки природных вод определяется соотношением расхода сорбента и объема очищаемой воды. На рисунке 2 показано увеличение величины сорбции ионов меди при постоянной навеске диатомита с увеличением объема раствора сульфата меди с концентрацией 0,03 М. При снижении отношения Т : Ж (где Т – твердая фаза, диатомит и Ж – жидкая фаза, раствор) происходит только частичное заполнение ионами меди активных центров поверхности. С увеличением объема раствора достигается состояние химического равновесия (А=0,25 мг/г).
Разработка сорбционной технологии связана с изучением равновесия сорбции. Полученные экспериментальные данные использовали для расчета удельной сорбции. Относительную величину сорбционного сродства диатомита к ионам меди можно установить по изотермам сорбции. На рисунке 3 представлено влияние концентрации ионов меди и температуры на величину сорбции.
При повышении температуры наблюдается повышение величины сорбции ионов меди: при 298К – 0,77 мг/г; при 318К – 0,90 мг/г; при 333К –1,01 мг/г. Полученные изотермы представляют собой вид кривых с насыщением. Резкий подъем начального участка изотерм подтверждает версию о сорбционном сродстве нативной формы диатомита к ионам меди. Результаты исследования показывают, что с увеличением концентрации исходного раствора происходит увеличение ионной силы раствора и активность поглощения ионов возрастает.
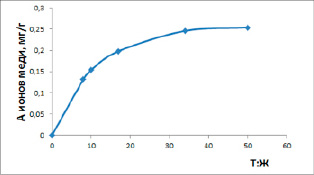
Рис. 2. Влияние ионов меди на сорбцию из раствора с концентрацией 0,03 М от соотношения Т:Ж
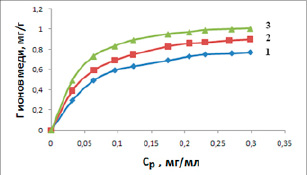
Рис. 3. Изотермы сорбции ионов меди при Т, К: 298 (1), 318 (2), 333(3)
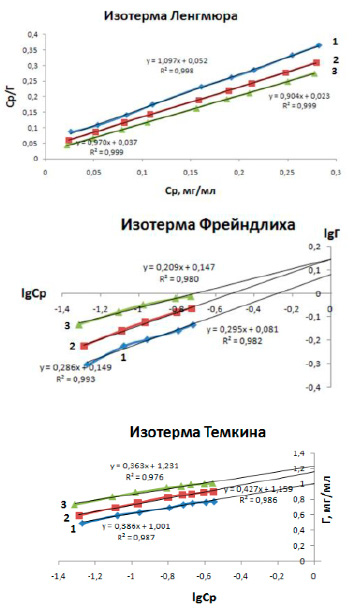
Рис. 4. Изотерма сорбции ионов меди на нативной форме диатомита в линейных координатах уравнений Ленгмюра, Фрейндлиха и Темкина при температуре: 1 – 298К; 2 – 318К; 3 – 333К
При анализе изотерм сорбции и расчете сорбционных параметров использовали теорию мономолекулярной сорбции с применением линейных уравнений Ленгмюра (2), Фрейндлиха (3) и Темкина (4) (рис. 4):
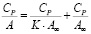 (2)
(2)
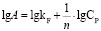 (3)
(3)
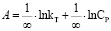 (4)
(4)
Применив модель Ленгмюра для обработки изотермы, определили два постоянных параметра: максимальную величину сорбции A∞ и константу сорбционного равновесия К – графической зависимостью, представленной на рисунке 4. Рассчитанные значения постоянных уравнения приведены в таблице 2. Согласно им, чем больше константа К, тем сильнее взаимодействие ионов меди с диатомитом. Из полученных данных можно видеть, что с увеличением температуры процесса сорбционная активность возрастает.
Линейная обработка изотерм сорбции ионов меди на диатомите представлена в таблице 2.
Таблица 2
Расчет параметров сорбции ионов меди по моделям
|
Модель Ленгмюра |
|||
|
Т, К |
A∞, ммоль/г |
K, |
R2 |
|
298 |
0,91 |
21,10 |
0,998 |
|
318 |
1,03 |
26,22 |
0,999 |
|
333 |
1,11 |
39,30 |
0,999 |
|
Модель Фрейндлиха |
|||
|
Т, К |
lgkF |
1/n |
R2 |
|
298 |
1,21 |
0,30 |
0,983 |
|
318 |
1,41 |
0,29 |
0,993 |
|
333 |
1,4 |
0,21 |
0,980 |
|
Модель Темкина |
|||
|
Т, К |
LgkT |
1/α |
R2 |
|
298 |
5,13 |
2,24 |
0,987 |
|
318 |
1,99 |
5,29 |
0,986 |
|
333 |
1,74 |
6,58 |
0,976 |
Модель Фрейндлиха имеет важное практическое применение: ее используют для анализа и расчета протекания сорбционных процессов. Путем применения зависимости lgA – lgCp были определены константы уравнения Фрейндлиха.
Модель Темкина имеет линейную зависимость.
По значениям коэффициентов корреляции (табл. 2) модель Ленгмюра подтверждает, что активные центры сорбента обладают равной энергией. Молекулы, образующие мономолекулярный слой, не взаимодействуют друг с другом. Из представленного рисунка 4 хорошо видно, что все точки зависимостей находятся на прямых линиях. Графическим методом с помощью рисунка 4 были найдены постоянные величины моделей (табл. 2). Процесс сорбции тяжелых металлов может носить характер физической сорбции, хемосорбции и ионного обмена между сорбатом и сорбентом [7, 8]. Кроме этого, обмен ионами у монтмориллонита происходит не только на внешней поверхности, но и внутри кристаллической решетки.
Выводы
Проведенные исследования диатомита Ирбитского месторождения Свердловской области и полученные результаты позволяют сделать следующие выводы.
1. Изотермы сорбции Cu2+ в широком интервале концентраций лучше описываются моделью Ленгмюра, подтверждает образование мономолекулярного слоя.
2. Максимальное значение сорбции при соотношении Т:Ж составляет 38.
3. Определено предельное значение сорбции: 0,91 мг/г сорбции Cu2+ из разбавленных растворов.
Библиографическая ссылка
Пимнева Л.А. ОЧИСТКА ПРИРОДНЫХ И ПРОМЫШЛЕННЫХ ВОД ОТ КАТИОНОВ МЕДИ ДИАТОМИТОМ // Успехи современного естествознания. 2022. № 12. С. 181-185;URL: https://natural-sciences.ru/ru/article/view?id=37968 (дата обращения: 04.02.2026).
DOI: https://doi.org/10.17513/use.37968



