Природные цеолиты представляют собой структурированные алюмосиликатные минералы с высокой способностью к катионному обмену и адсорбции ионов. Их структура состоит из каркаса кремнекислородных тетраэдров [SiO4]4–, соединенных по углам друг с другом общими атомами кислорода. Изоморфное замещение Si4+ на Al3+ в тетраэдрических узлах приводит к избыточному отрицательному заряду, который уравновешивается катионами щелочных и щелочноземельных металлов. Ионы щелочных и щелочноземельных металлов обеспечивают цеолитам ионообменные и молекулярно-ситовые свойства. С другой стороны, высокоразвитая внутренняя поверхность цеолитов за счет пор и каналов объясняет их молекулярно-ситовые свойства.
Цеолиты довольно широко применяются как сорбенты при очистке сточных вод и как катализаторы при синтезе органических соединений. Они являются эффективными сорбентами по отношению к тяжелым металлам, таким как никель, медь, свинец, кадмий и др. [1–3]. Применение природных сорбентов для очистки рудничных вод от тяжелых металлов [3] показало, что в динамических условиях морденитовый туф способен поглощать ионы свинца, кадмия, меди, вольфрама. При изучении кинетики и механизмов сорбции тетрахлорозолотоводородной кислоты [4] цеолитовыми туфами месторождений Забайкалья установлено, что лимитирующей стадией является внутридиффузионный механизм. Цеолитовые субстраты используются также при очистке сточных вод. Ранее авторы изучали сорбцию цветных металлов из технологических растворов бактериально-химического выщелачивания кобальт-медно-никелевых руд [1], сорбцию бора и лития из геотермальных теплоносителей [5] природными и модифицированными цеолитами.
Анализ литературных данных показал, что в печати имеются ограниченные сведения по сорбции золота натуральными, синтетическими цеолитами и цеолитовыми туфами, поэтому проблема изучения сорбции золота природными материалами в настоящее время является актуальной.
Целью настоящей работы является установление характеристик сорбции золота цеолитами морденит-клиноптилолитового типа (МРД-КЛП) Ягоднинского месторождения Камчатского края и цеолитами гейландит-клиноптилолитового типа (ГЛНД-КЛП) Середочного месторождения Хабаровского края в статическом режиме.
Материалы и методы исследования
Экспериментальные исследования проводили в статическом режиме методом ограниченного объема при комнатной температуре (20±2ºС). Навески подготовленных образцов цеолитов с размерами гранул 0,25–0,5 мм приводили в контакт с солянокислыми растворами золота различной концентрации. Стандартизацию растворов проводили по ГСО 8429-2003. Соотношение твердого к жидкому поддерживали на уровне 1:50. Через 24 часа сорбент отделяли от раствора. Равновесное содержание золота анализировали методом ICPE-9000 с индуктивно-связанной плазмой фирмы Shimadzu (Япония).
Минеральный состав цеолитовых туфов определяли на рентгеновском дифрактометре RIGAKU Ultima-IV (Япония) (Cu Kα). Мощность генератора рентгеновского излучения – 40 кВ и 30 мА, скорость сканирования –1,0 град./мин., с шагом 0,02 град., в угловом диапазоне от 3 до 50 град. (2 theta). Расшифровку дифрактограмм выполняли методом Ритвельда с использованием программы PDXL, работающей на персональном компьютере. Для идентификации кристаллических фаз использовали базы данных ICDD – Международного центра дифракционных данных для неорганических веществ.
Результаты исследования и их обсуждение
Для оценки адсорбции золота цеолитами двух дальневосточных месторождений – Ягоднинского месторождения Камчатского края и Середочного месторождения Хабаровского края – были выбраны три важнейшие модели, описываемые уравнениями Ленгмюра, Фрейндлиха и Дубинина-Радушкевича.
Статическую обменную емкость (A, ммоль/г) рассчитывали по уравнению:
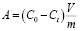 ,
,
где С0 и Сt – начальная и равновесная концентрации вещества в растворе, ммоль/л; V – объем раствора, л; m – навеска сорбента, г.
Для описания изотермы адсорбции использовали уравнение Лэнгмюра:
 ,
,
где Amax – предельная сорбционная емкость ммоль/г, k – константа адсорбционного равновесия, характеризующая энергию взаимодействия адсорбента и адсорбата. Линейная форма уравнения Лэнгмюра имеет вид:
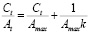 (1)
(1)
Характеристики уравнения Ленгмюра могут быть выражены безразмерной константой, называемой коэффициентом распределения (или параметром равновесия) RL:
 .
.
Адсорбция считается необратимой при RL=0, благоприятной при 0<RL<1, линейной при RL=1 и неблагоприятной при RL> 1 [6; 7].
Свободную энергию Гиббса ΔG рассчитывали по формуле:
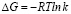 ,
,
где R – универсальная газовая постоянная, равная 8,314 Дж/моль·град К; Т – температура в градусах Кельвина; k – константа адсорбционного равновесия.
Для изотерм сорбции, имеющих параболический характер, зависимость сорбционной емкости от концентрации может быть описана эмпирическим уравнением Фрейндлиха:
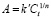 ,
,
где 1/n – константа, показатель степени, зависящий от температуры и природы адсорбата, k’ – константа Фрейндлиха. В логарифмических координатах – это уравнение прямой:
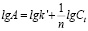 . (2)
. (2)
Коэффициенты в уравнениях (1 и 2) определяли графически.
Изотерма Дубинина-Радушкевича [6; 7], применяемая для обработки экспериментальных данных, линеализуется в логарифмической форме:
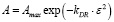
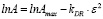 , (3)
, (3)
где ε – потенциал Поляни 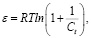 kDR – константа адсорбционного равновесия Дубинина-Радушкевича.
kDR – константа адсорбционного равновесия Дубинина-Радушкевича.
Цеолитовое сырье Ягоднинского месторождения Камчатского края по минеральному составу относится к клиноптилолитовому типу, к клиноптилолитовому и морденит-клиноптилолитовому подтипу. По данным рентгеноструктуного анализа, минералы в партии цеолитового туфа Ягоднинского месторождения, используемого для экспериментальной части настоящей работы, представлены клиноптилолитом-Ca (52,1%), клиноптилолитом-Na (23,0%) и морденитом (до 12,9%), анортитом (10,7%), альбитом (0,84%), кристобалитом (0,46%). Таким образом, цеолитовые минералы составляют 88% от массы цеолитового туфа. Степень замещенности кремния на алюминий в кремнекислородных тетраэдрах можно оценить по соотношению SiO2/Al2O3. В цеолитовой фракции МРД-КЛП такое соотношение составило 5,52. Содержание обменных катионов располагается в ряд Mg2+<Ca2+<Na+<K+.
Цеолитовый туф Середочного месторождения представлен клиноптилолитом (61,0%), гейландитом (3,4%), морденитом (0,6%), кварцем различных модификаций (до 21%), анортитом (9,8%) и до 4% глинистых минералов типа иллита. На долю цеолитовых минералов приходится 65% общей массы цеолитового туфа. Соотношение SiO2/Al2O3 равно 3,56. Содержание обменных катионов располагается в ряд Na+<Mg2+<Ca2+<K+.
Результаты экспериментальных исследований отображены на графиках (рис. 1–3) и в таблицах 1 и 2.
На графике (рис. 1) представлены экспериментальные результаты координат уравнения Ленгмюра (уравнение 1).
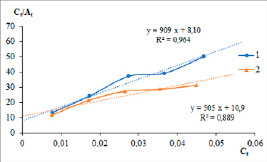
Рис. 1. Зависимость отношения равновесной концентрации к сорбционной емкости цеолитов от величины равновесной концентрации золота в растворе (модель Ленгмюра): 1 – МРД-КЛП; 2 – ГЛНД-КЛП
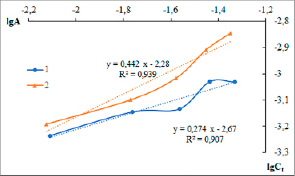
Рис. 2. Зависимость логарифма сорбционной емкости цеолитов от логарифма равновесной концентрации цветных металлов (модель Фрейндлиха): 1 – МРД-КЛП; 2 – ГЛНД-КЛП
Подчеркнем, что теория мономолекулярной адсорбции Ленгмюра не учитывает химическое взаимодействие адсорбата с активными центрами адсорбента, кроме этого, в теории существует допущение, что все активные центры твердой фазы однородны. В действительности при работе с природными материалами, такими как цеолиты, эти допущения должны иметь погрешности. Внутренняя поверхность цеолитов имеет сложную геометрию, разнородный минеральный состав, а также не только индивидуальные кристаллы минералов, но и сростки минеральных зерен. Тем не менее при расчетах сорбционных характеристик цеолитовых туфов МРД-КЛП и ГЛНД-КЛП по уравнению Ленгмюра получены высокие значения коэффициентов корреляции R2, равные 0,964 и 0,989 соответственно. Отметим, что сорбционная емкость ГЛНД-КЛП почти в два раза выше, чем емкость МРД-КЛП, и составляет 1,10 и 1,98 ммоль/кг (табл. 1). Высокие значения констант адсорбционного взаимодействия k: 112 ед. при сорбции на МРД-КЛП и 46 ед. при сорбции золота на ГЛНД-КЛП, характеризуют энергию взаимодействия ионов на общей поверхности твердой фазы. Рассчитанные значения энергии Гиббса, равные ΔG= –28,3 кДж/моль при сорбции золота из солянокислых растворов на МРД-КЛ и ΔG= –26,2 кДж/моль при сорбции на ГЛНД-КЛП, позволяют предположить, что соответствующие ионы устойчиво закрепляются на поверхности цеолита, сорбция проходит уверенно.
При расчетах, проведенных по адсорбционной теории Фрейндлиха (рис. 2, уравнение 2), получены коэффициенты корреляции R2, равные 0,939 при сорбции золота туфом МРД-КЛП и 0,907 при сорбции туфом ГЛНД-КЛП. Константа адсорбции Фрейндлиха зависит от природы адсорбента и адсорбата. Физический смысл константы заключается в том, что при равновесной концентрации, равной единице, она численно равна сорбционной емкости. Рассчитанные значения k’ при сорбции на МРД-КЛП составляют 2,1·10-3, а при сорбции на ГЛНД-КЛП – 5,2·10-3 (табл. 1).
Таблица 1
Сорбционные характеристики поглощения ионов золота цеолитами Ягоднинского месторождения Камчатского края и Середочного месторождения Хабаровского края
|
Цеолит, месторождение |
Уравнение Ленгмюра |
ΔG, кДж/моль |
Уравнение Фрейндлиха |
|||||
|
Аmax, ммоль/г |
k |
R2 |
RL |
n |
k’ |
R2 |
||
|
Ягоднинское Середочное |
1,10·10-3 1,98·10-3 |
112 46 |
0,964 0,989 |
0,160 0,326 |
–28,3 –26,2 |
3,66 2,26 |
2,1·10-3 5,2·10-3 |
0,939 0,907 |

Рис. 3. Зависимость натурального логарифма сорбционной емкости от квадрата потенциала Поляни (модель Дубинина-Радушкевича): 1 – МРД-КЛП; 2 – ГЛНД-КЛП
Таблица 2
Сорбционные характеристики поглощения ионов золота цеолитами Ягоднинского месторождения Камчатского края и Середочного месторождения Хабаровского края (параметры модели Дубинина-Радушкевича)
|
Цеолит |
Со, мг/л |
Аmax, ммоль/г |
KDR, моль2/кДж2 |
E, кДж/моль |
R2 |
|
МРД-КЛП |
2–6 6–10 |
1,02·10-3 1,78·10-3 |
0,0039 0,0114 |
11,3 6,62 |
0,950 0,993 |
|
ГЛНД-КЛП |
2–6 6–10 |
1,53·10-3 4,47·10-3 |
0,0062 0,0192 |
8,98 5,10 |
0,968 0,996 |
В отличии от моделей Ленгмюра и Фрейндлиха, модель Дубинина-Радушкевича позволяет определить характер взаимодействия адсорбата и адсорбента. Критерием является величина свободной энергии адсорбции E, которая связана с константой Дубинина-Радушкевича следующим уравнением:
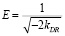
По литературным данным [7] известно, что при низких значениях свободной энергии адсорбционного взаимодействия (<8 кДж/моль) наблюдается физическая адсорбция, при более высоких значениях (>8 кДж/моль) механизм адсорбции ионообменный. Практическое применение теории Дубинина-Радушкевича показало следующие результаты.
Как видно из графика, представленного на рисунке 3, зависимость ln A от ε2 мультилинейна. Прослеживаются два участка, которые можно разграничить по диапазонам концентрации адсорбата. В таблице 2 представлены результаты графоаналитических расчетов по модели Дубинина-Радушкевича.
При сорбции из растворов, содержащих от 2 до 6 мг/л ионов золота, свободная энергия адсорбции на МРД-КЛП равна 11,32 кДж/моль, на ГЛНД-КЛП – 8,98 кДж/моль, что соответствует ионообменному механизму. При сорбции из растворов с содержанием золота от 6 до 10 мг/л свободная энергия адсорбции на МРД-КЛП составляет 6,62 кДж/моль, на ГЛНД-КЛП – 5,1 кДж/моль, что свидетельствует о физической адсорбции, вероятно, за счет порового пространства.
Заключение
Цеолиты Ягоднинского месторождения Камчатского края и Середочного месторождения Хабаровского края представляют собой перспективные сорбенты для извлечения из водных растворов ионов золота в диапазоне концентраций от 2 до 10 мг/л.
Рассчитанные константы в уравнениях Ленгмюра характеризуют взаимодействие ионов золота с поверхностью цеолитовых туфов, включая внутреннюю поверхность. Значения энергии Гиббса равны, кДж/моль: ΔG= –28,3 и ΔG= –26,2 для цеолитовых туфов Ягоднинского и Середочного месторождений соответственно.
Анализ экспериментальных данных с использованием модели Дубинина-Радушкевича показал, что в зависимости от исходной концентрации золота механизм сорбции различается. Так, в диапазоне концентраций от 2 до 6 мг/л преобладает ионообменный механизм, в диапазоне концентраций от 6 до 10 мг/л – механизм физико-химической сорбции.
Библиографическая ссылка
Белова Т.П. ПРИМЕНЕНИЕ АДСОРБЦИОННЫХ МОДЕЛЕЙ ДЛЯ ОПИСАНИЯ СОРБЦИИ ЗОЛОТА ИЗ ХЛОРИДНЫХ РАСТВОРОВ ПРИРОДНЫМИ ЦЕОЛИТАМИ В СТАТИЧЕСКОМ РЕЖИМЕ // Успехи современного естествознания. 2023. № 7. С. 82-87;URL: https://natural-sciences.ru/ru/article/view?id=38075 (дата обращения: 07.01.2026).
DOI: https://doi.org/10.17513/use.38075



