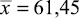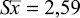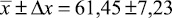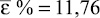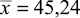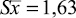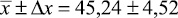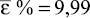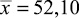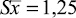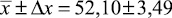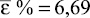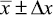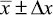Цефоперазон находит широкое применение при лечении заболеваний дыхательных путей, инфекций кожи, мягких тканей, костей, суставов, а также – для профилактики инфекционных послеоперационных осложнений [1, 3, 5]
Вместе с тем при определённых условиях (индивидуальная непереносимость, передозировка, патологии внутренних органов) антибиотик может вызывать острые отравления, вплоть до смертельного исхода. При этом решающими в диагностике отравлений являются результаты химико-токсикологического (судебно-химического) исследования биологического материала.
В процессе проведения эффективной антибиотикотерапии в хирургической практике возникает необходимость использования современных аналитических методов для контроля уровня содержания антибиотика в биосубстратах операционного поля пациентов, так как терапевтический эффект препарата в значительной степени зависит от концентрации в очаге микробного поражения [6].
В литературе имеются сведения об использовании для анализа цефоперазона в биологических жидкостях хроматографических методов (ТСХ, ВЭЖХ) [2, 7, 8]. Однако отсутствуют методики анализа цефоперазона в тканях органов, в том числе операционного поля. При этом к методикам анализа такого рода предъявляется ряд важных требований: использование минимального веса биосубстрата (не более 0,1 г), экспрессность пробоподготовки, хода анализа, высокая чувствительность (граница определения должна составлять менее 1 мкг антибиотика в исследуемой пробе.
Немаловажное значение имеет доступность аналитических систем для лаборатории. В плане решения вопроса по импортозамещению в настоящее время уделяют пристальное внимание при укомплектовании лабораторий современными отечественными приборами.
К новым эффективным физико-химическим методам относится капиллярный электрофорез, характеризующийся достаточно высокой экспрессностью, чувствительностью и разделительной способностью. Такие доступные сепарационные системы, не уступающие импортной продукции, производит отечественная научно-производственная фирма «Люмекс», г. Санкт-Петербург.
Целью исследования явилось изучение возможности определения цефоперазона в тканях органов методом капиллярного электрофореза с использованием отечественной системы – «Капель-105М».
При разработке методики определения цефоперазона в ткани печени (модельные смеси) было проведено сравнительное изучение влияния природы экстрагента на степень экстрагирования антибиотика (ацетонитрил, водный раствор натрия гидроксида, рН, 9,0; буферный раствор Бриттона – Робинсона, рН, 9,0). С этой целью к 0,1 г измельчённой печени, содержащей 20 мкг цефоперазона, добавляли 0,4 мл одного из вышеперечисленных экстрагентов. Перемешивали и оставляли в защищённом от света месте при периодическом встряхивании. Через 10 минут смесь центрифугировали (6000 об/мин, 5 мин). Надосадочную жидкость отделяли, добавляли 10 % раствор хлористоводородной кислоты до рН 2,0 (по универсальной индикаторной бумаге) и проводили экстракцию органической системой растворителей (хлороформ – изобутанол, 3:1), (1 мл/3) в течение 10 минут. Смесь центрифугировали (6000 об/мин, 10 мин). К объединённым экстрактам добавляли 1 мл раствора Бриттона – Робинсона, рН 9,0, разбавленного водой в 10 раз (РП), и проводили реэкстрагирование (10 минут). Смесь центрифугировали (6000 об/мин, 10 мин). Реэкстракт отделяли, дегазировали центрифугированием при 10000 об/мин в течение 5 минут (центрифуга Mini spin plus) и использовали для количественного определения методом капиллярного электрофореза («Капель-105М») согласно разработанной нами методике определения цефоперазона – стандарта при условиях электрофореза: рабочий электролит (РЭ) – буферный раствор Бриттона – Робинсона, рН 9,0, растворитель пробы (РП) – РЭ, разбавленный в 10 раз водой; ввод пробы – давлением (30 мбар/15 с); положительный электрод со стороны введения РЭ (напряжение: +20 кВ); детектирование в УФ области, 230 нм [4]. Результаты исследования, представленные в табл. 1, показали, что наибольшая степень экстракции цефоперазона наблюдается при использовании в качестве экстрагента водного раствора натрия гидроксида, рН 9,0 и составляет 62,30 % (при внесении 20 мкг антибиотика в 0,1 г печени).
Методика количественного определения цефоперазона в печени, с использованием в качестве экстрагента водного раствора натрия гидроксида, рН 9,0, была подвергнута валидации на трёх уровнях концентрации: 20,0, 10,0 и 0,1 мкг в 0,1 г печени, при пяти повторностях. Результаты валидационной оценки представлены в табл. 2.
Метрологическая характеристика полученных данных показывает, что количественное определение цефоперазона в модельных смесях тканей печени на трёх уровнях концентрации характеризуется удовлетворительной сходимостью результатов в пределах рекомендуемой аналитической области. Рассчитанное стандартное отклонение среднего результата находится в пределах критерия приемлемости. Граница определения составляет 0,1 мкг цефоперазона в ткани печени.
Идентификацию цефоперазона на электрофореграмме (ЭФГ) осуществляли по времени миграции аналита в мин (tm). При этом исследования с контрольной пробой печени показали, что отсутствуют посторонние пики в интервале выхода цефоперазона (рис. 1).
Таблица 1
Влияние природы экстрагента на степень экстрагирования цефоперазона из печени
|
№ п/п |
Экстрагент |
Цефоперазон 20 мкг/0,1 г печени |
|
|
Определено цефоперазона ( |
|||
|
мкг |
% |
||
|
1. |
Водный раствор натрия гидроксида, рН 9,0 |
12,46 |
62,30 |
|
2. |
Буферный раствор Бриттона – Робинсона, рН 9,0 |
9,41 |
47,03 |
|
3. |
Ацетонитрил |
9,33 |
46,65 |
Таблица 2
Валидационная оценка методики количественного определения цефоперазона в ткани печени (экстрагент – водный раствор натрия гидроксида, рН 9,0)
|
№ п/п |
Цефоперазона в 0,1 г печени |
Определено цефоперазона |
Метрологические характеристики |
|
|
мкг |
% |
|||
|
1. |
20,0 |
13,25 |
66,25 |
S = 5,81
СV % = 9,46
|
|
2. |
20,0 |
12,82 |
64,10 |
|
|
3. |
20,0 |
11,31 |
56,60 |
|
|
4. |
20,0 |
13,28 |
66,40 |
|
|
5. |
20,0 |
10,78 |
53,90 |
|
|
6. |
Контрольный опыт |
– |
– |
|
|
7. |
10,0 |
4,216 |
42,16 |
S = 3,63
СV % = 8,03
|
|
8. |
10,0 |
4,60 |
46,00 |
|
|
9. |
10,0 |
4,835 |
48,35 |
|
|
10. |
10,0 |
4,89 |
49,80 |
|
|
11. |
10,0 |
5,035 |
50,35 |
|
|
12. |
Контрольный опыт |
– |
– |
|
|
19. |
0,1 |
0,05261 |
52,61 |
S = 2,80
СV % = 5,38
|
|
20. |
0,1 |
0,05070 |
50,70 |
|
|
21. |
0,1 |
0,04864 |
48,64 |
|
|
22. |
0,1 |
0,05625 |
56,25 |
|
|
23. |
0,1 |
0,05231 |
52,31 |
|
|
24. |
Контрольный опыт |
– |
– |
|
1 2
3 4
Рис. 1. Время миграции (tm) цефоперазона, выделенного из печени: 20 мкг/0,1 г печени (1), 10 мкг/0,1 г печени (2), 0,1 мкг/0,1 г печени (3), контрольная проба печени (4)
Разработанная нами экспрессная методика определения цефоперазона в биологическом материале с использованием метода капиллярного электрофореза была применена для изучения уровня концентрации цефоперазона в тканях операционного поля, взятых от оперируемых больных. Исследования проводились с участием кафедры общей хирургии ГБОУ ВПО «Ярославского государственный медицинский университет» (заведующий кафедрой, д.м.н., профессор А.Б. Ларичев), находящейся на базе ГБКУЗ ЯО «Городская больница им. Н.А. Семашко», на группе оперируемых больных, которым однократно внутривенно вводили 1 г цефоперазона. Отбор проб субстанций с операционного поля проводили через определенные промежутки времени (навески не превышают 0,1 г исследуемой ткани). Последующую пробоподготовку объекта, определение цефоперазона проводили согласно разработанной методике на модельных смесях печени.
Результаты определения и идентификации цефоперазона в клинических объектах представлены в табл. 3 и на рис. 2, 3.
Таблица 3
Мониторинг уровней концентрации цефоперазона в тканях операционного поля
|
Группа |
Концентрация цефоперазона в тканях операционного поля, мкг/0,1 г |
||||
|
Брюшина |
Апоневроз |
Кожа |
Мышца |
Подкожно-жировая клетчатка |
|
|
40 минут |
|||||
|
1. |
18,47 |
6,75 |
5,60 |
1,89 |
0,81 |
|
2. |
18,83 |
7,37 |
5,56 |
2,11 |
0,60 |
|
3. |
19,95 |
4,31 |
6,03 |
2,23 |
0,95 |
|
|
19,08 ± 0,96 |
6,14 ± 2,01 |
6,73 ± 0,32 |
2,08 ± 0,21 |
0,79 ± 0,22 |
|
60 минут |
|||||
|
1. |
10,94 |
29,00 |
16,25 |
3,90 |
3,23 |
|
2. |
15,49 |
25,16 |
10,22 |
4,55 |
3,29 |
|
3. |
15,16 |
33,17 |
13,63 |
3,76 |
3,69 |
|
|
13,86 ± 3,15 |
29,24 ± 5,23 |
13,37 ± 3,76 |
4,07 ± 0,52 |
3,41 ± 0,30 |
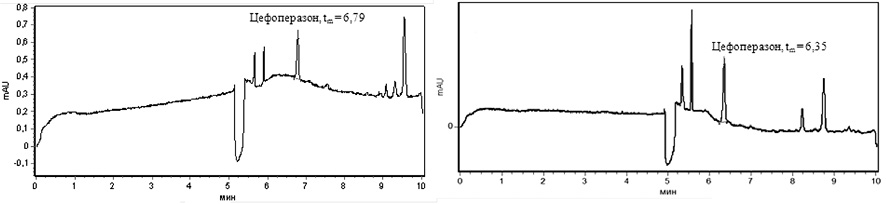
1 2
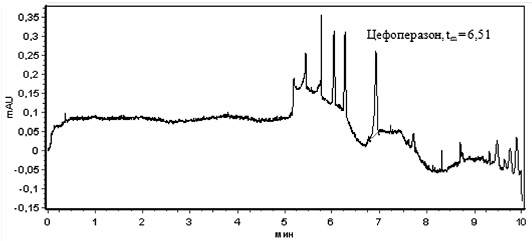
3
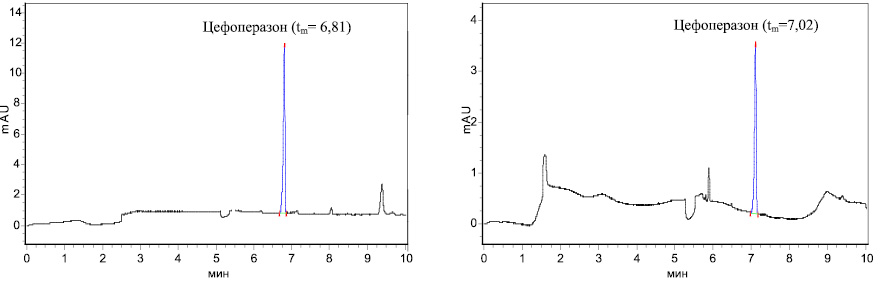
Рис. 2. ЭФГ цефоперазона, выделенного из брюшины (1), апоневроза (2) и кожи (3) через 40 минут после введения антибиотика
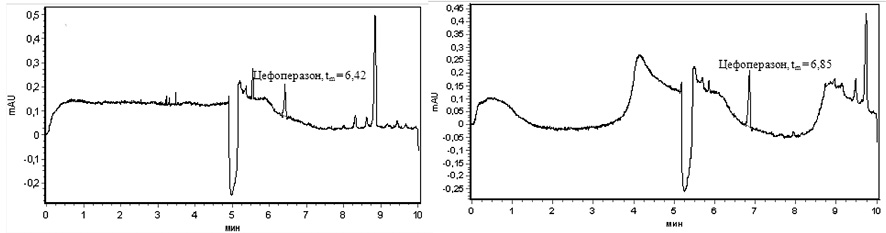
1 2
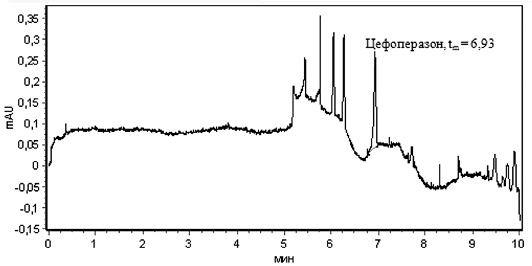
3
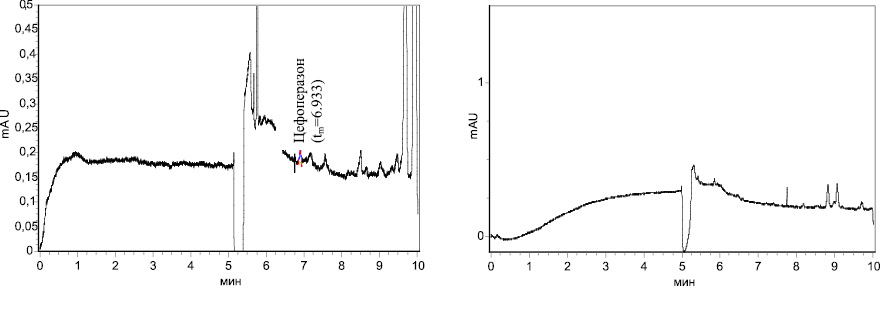
Рис. 3. ЭФГ цефоперазона, выделенного из брюшины (1), апоневроза (2) и кожи (3) через 60 минут после введения антибиотика
Результаты исследований показали, что наибольшее количество цефоперазона содержится в брюшине, апоневрозе и коже, значительно меньше определено в мышечной ткани и подкожной жировой клетчатке.
Выводы
1. Проведена сравнительная характеристика методик выделения цефоперазона из ткани печени (модельные смеси). При этом наибольшая степень выделения наблюдается при использовании в качестве извлекателя водного раствора натрия гидроксида, рН 9,0 (65,60 % при внесении 20 мкг вещества в 0,1 г печени).
2. Разработанная методика количественного определения цефоперазона в ткани печени является доступной, экспрессной и валидной по критериям сходимости и правильности результатов измерений в пределах рекомендуемых аналитических областей. Граница определения исследуемого антибиотика в ткани печени составляет 0,1 мкг вещества 0,1 г печени.
3. Мониторинг уровней концентраций цефоперазона в тканях операционного поля у пациентов с хирургическим вмешательством через 40 и 60 минут после введения антибиотика показывает неравномерную локализацию цефоперазона в тканях операционного поля. Наибольшие количества цефоперазона обнаруживаются в тканях брюшины, апоневроза и коже.




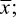 n = 3)
n = 3)