Введение
Развивающаяся вследствие термических поражений ожоговая болезнь всегда сопровождается интоксикацией, обусловленной многочисленными неспецифическими токсическими метаболитами [2, 7]. Важнейшим защитным гомеостатическим барьером организма служит система биотрансформации, которая обеспечивает гидрофилизацию ксенобиотиков и эндотоксинов и осуществляется ферментами микросомального и немикросомального окисления. Немикросомальные энзимы – это алкогольдегидрогеназа (АДГ) и альдегиддегидрогеназа.
Главной функцией АДГ является поддержание равновесия во взаимопревращениях эндогенных альдегидов и спиртов. Одним из основных субстратов АДГ служит постоянно образующийся в организме из многочисленных предшественников ацетальдегид [1, 3, 4], который, повреждая ряд энзимов, надмолекулярных образований мембран, индуцирует разнообразные патологические процессы, в том числе модификацию аминогрупп белков с образованием ацетальдегидных аддуктов. АДГ участвует в метаболизме ретиноидов, оксижирных кислот, катаболизме нейромедиаторов, превращениях стероидных гормонов, процессах синтеза холестерина и желчных кислот, детоксикации продуктов перекисного окисления липидов [1]. Постоянно растет число ксенобиотиков, в обезвреживании которых АДГ принадлежит важная роль. При этом в определенных процессах АДГ, напротив, продуцирует повреждающие соединения. Таким образом, исследование регуляторных свойств АДГ в норме и при термической травме является актуальным.
Цель работы – изучение каталитических и кинетических свойств алкогольдегидрогеназы в различных органах крыс при экспериментальном ожоге.
Материалы и методы исследования
Исследования были проведены на белых крысах линии Wistar обоего пола массой 180-250 г. Животных разделили на две группы: интактная (контрольная, n=8) и опытная (n=10). Под эфирным наркозом крысам опытной группы наносили ожог кипятком на тщательно освобожденных от шерсти 20 %-ах поверхности спины (экспозиция – 3 с), забивали путем декапитации на 3-и, 7-е и 10-е сутки после травмы. Исследования проводили в гомогенатах органов (печень, почки, сердце и легкие) [8]. Активность АДГ определяли с использованием в качестве субстрата этилового спирта (прямая реакция, АДГпр) и ацетальдегида (обратная реакция, АДГобр) по методу W. M. Keung et al. (1989) [9]. Концентрацию белка вычисляли по методу Лоури в модификации. Рассчитывали кинетические характеристики АДГ: Kt – время достижения ½Vmax ферментативной реакции (мин), где Vmax – максимальная скорость накопления продукта реакции (мкмоль/мин); Кa (Vmax/Kt) – коэффициент каталитической эффективности (мкмоль/мин2) [5]. Результаты исследований обрабатывали с использованием t-критерия Стьюдента с помощью программы BIOSTAT.
Результаты и их обсуждение
Полученные результаты показали, что распределение общей активности АДГ в обратной реакции у интактных крыс и у опытных животных на 3-и и 7-е сутки уменьшается в ряду: печень → легкие → почки → сердце (рис. 1), что подтверждает литературные данные [10].
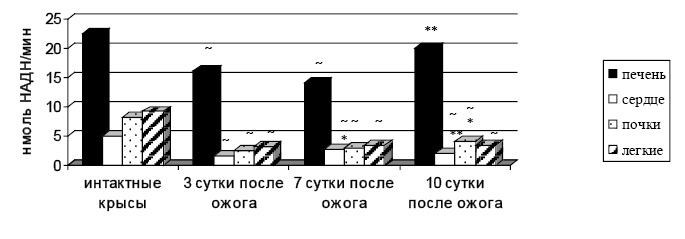
Рис. 1. Общая активность алкогольдегидрогеназы в обратной реакции в норме и при ожоге
~ – статистически значимо по сравнению с интактными крысами (р≤0,05); * – статистически значимо по сравнению с 3-ми сутками (р≤0,05); ** – статистически значимо по сравнению с 7-ми сутками (р≤0,05).
На 10-е сутки после ожога наблюдается перераспределение общей активности АДГобр (в порядке уменьшения): печень → почки → легкие → сердце. Преобладание АДГобр в почках по сравнению с легкими при термической травме, вероятно, обусловлено более выраженным падением удельной активности АДГобр в легких на 10-е сутки после поражения (табл. 1). Удельная активность, также как и общая, АДГобр статистически значимо уменьшается во всех органах и на всех исследуемых сутках после ожога по сравнению с интактными животными. В печени удельная активность снижается на 16,6 % на 3-и сутки, 38,3 % на 7-е и на 20,2 % на 10-е сутки после травмы (табл. 1).
Таблица 1
Удельная активность АДГ (нмоль НАДН/мин×мг белка) в норме и при ожоге
|
Орган |
Активность |
Интактные крысы |
Крысы с ожогом |
||
|
3 сутки |
7 сутки |
10 сутки |
|||
|
Печень |
АДГпр |
47,39±2,55 |
34,72±1,02# |
17,05±1,19 #/* |
25,82±1,55 #/*/** |
|
АДГобр |
107,90±3,03 |
89,95±5,49# |
66,63±4,53#/* |
86,12±3,24#/** |
|
|
Сердце |
АДГпр |
17,40±1,95 |
11,49±2,80 |
8,52±0,32# |
18,46±0,43 */** |
|
АДГобр |
65,86±2,18 |
15,46±1,41# |
25,48±2,72#/* |
17,53±1,28#/** |
|
|
Почки |
АДГпр |
15,25±1,04 |
32,61±2,85# |
29,29±1,27# |
49,48±1,14 #/*/** |
|
АДГобр |
48,68±2,99 |
12,91±1,71# |
14,91±0,98# |
33,36±1,14#/*/** |
|
|
Легкие |
АДГпр |
84,13±3,87 |
96,38±12,15 |
64,90±3,82#/* |
72,80±2,75# |
|
АДГобр |
122,10±8,85 |
50,44±4,77# |
67,40±1,62# |
60,47±1,49 #/*/** |
|
Примечания: # – статистически значимо по сравнению с интактными крысами (р≤0,05); * – статистически значимо по сравнению с 3-ми сутками (р≤0,05); ** – статистически значимо по сравнению с 7-ми сутками (р≤0,05).
Максимальное снижение активности в печени, обусловленное статистически значимым выраженным увеличением Kt в 1,9 раз, наблюдается на 7-е сутки после ожога, в отличие от других органов с наибольшим падением активности фермента на 3-и сутки, свидетельствуя о том, что печень позднее реагирует на эндогенную интоксикацию. На 3-и и 10-е сутки после ожога Kt возрастает в 1,2 и 1,5 раза соответственно (табл. 2). В легких удельная активность АДГобр снижается на 58,7 % на 3-и сутки, 44,8 % на 7-е сутки и 50,5 % на 10-е сутки после травмы. Из данных табл. 2 видно, что Kt для АДГобр в легких увеличивается в 3,7 раза на 3-и сутки и в 2,8 раз на 7-е и 10-е сутки. В сердце удельная активность АДГобр уменьшается в наибольшей степени (на 76,5 %) на 3-и сутки, на 61,3 % на 7-е сутки и на 73,4 % на 10-е сутки после термической травмы. При этом Kt для АДГобр статистически значимо увеличивается на 3-и сутки в 1,3 раза и в 1,4 раза на 10-е сутки, что свидетельствует о снижении сродства фермента к субстрату. Кa уменьшается в 3,9 раз на 3-и сутки и в 3,4 раза на 7-е и 10-е сутки после ожога (табл. 2).
Таблица 2
Кинетические характеристики АДГ у интактных крыс и крыс с ожогом
|
Показатель |
Интактные крысы |
Крысы с ожогом |
||||
|
3 сутки |
7 сутки |
10 сутки |
||||
|
Kt, мин |
печень |
АДГпр |
1,45±0,12 |
1,77±0,08# |
2,70±0,05#/* |
2,17±0,11#/*/** |
|
АДГобр |
2,76±0,06 |
7,45±0,33# |
15,45±2,15#/* |
9,44±1,05#/*/** |
||
|
сердце |
АДГпр |
3,25±0,18 |
3,40±0,05 |
4,71±0,82#/* |
3,35±0,37 |
|
|
АДГобр |
0,96±0,04 |
1,27±0,07# |
1,03±0,05* |
1,30±0,07#/** |
||
|
почки |
АДГпр |
2,03±0,05 |
0,85±0,06# |
1,23±0,09#/* |
0,75±0,04#/** |
|
|
АДГобр |
1,06±0,03 |
2,00±0,05# |
1,51±0,13#/* |
1,25±0,03#/*/** |
||
|
легкие |
АДГпр |
1,37±0,18 |
1,60±0,05 |
2,00±0,09#/* |
2,00±0,02#/* |
|
|
АДГобр |
0,61±0,04 |
2,25±0,12# |
1,70±0,02#/* |
1,70±0,05#/* |
||
|
Ka, мкмоль/ мин2 |
печень |
АДГпр |
0,97±0,04 |
0,24±0,01# |
0,24±0,02# |
0,80±0,08* |
|
АДГобр |
1,21±0,08 |
0,87±0,01# |
1,23±0,12* |
0,82±0,05#/** |
||
|
сердце |
АДГпр |
0,34±0,02 |
0,28±0,01# |
0,45±0,04#/* |
0,39±0,04* |
|
|
АДГобр |
0,82±0,06 |
0,21±0,02# |
0,24±0,02# |
0,24±0,03# |
||
|
почки |
АДГпр |
0,56±0,03 |
0,25±0,00# |
0,31±0,03# |
0,54±0,02*/** |
|
|
АДГобр |
0,37±0,01 |
0,10±0,00# |
0,67±0,02#/* |
0,18±0,02#/*/** |
||
|
легкие |
АДГпр |
0,15±0,00 |
0,09±0,01# |
0,06±0,00#/* |
0,04±0,00#/*/** |
|
|
АДГобр |
0,33±0,01 |
0,26±0,03 |
0,04±0,00 #/* |
0,14±0,01 #/*/** |
||
Примечания: # – статистически значимо по сравнению с интактными крысами (р≤0,05); * – статистически значимо по сравнению с 3-ми сутками (р≤0,05); ** – статистически значимо по сравнению с 7-ми сутками (р≤0,05).
Согласно литературным данным, с одной стороны, главной причиной патологических изменений миокарда является ожоговая интоксикация [7]. С другой стороны, поражения миокарда при термической травме лишены специфичности. Поводом для их появления является несоответствие между количеством притекающей к сердцу крови и функциональной потребностью в ней, что постоянно создается при ожоге, сопровождающемся рефлекторными нарушениями регуляции кровообращения.
В почках также происходит падение активности АДГобр (на 73,5 % на 3-и сутки, на 69,4 % на 7-е сутки, на 31,5 % на 10-е сутки), которое сопровождается уменьшением сродства АДГ к субстрату и статистически значимым увеличением Kt в 1,9 раз на 3-и сутки, 1,4 раза на 7-е и в 1,2 раза на 10-е сутки после термической травмы. Ka снижается в 3,7 раза на 3-и, в 2,0 раза на 10-е сутки (табл. 2). В.А. Корячкин и др. (2002) высказали предположение, что нарушение функции почек при ожогах может иметь своей причиной воздействие токсических продуктов на их паренхиму и уменьшение притока крови к органу [6].
Полученные результаты говорят о пропорциональном изменении Kt и активности АДГобр во всех исследуемых органах – чем больше увеличивается время достижения ½ Vmax, тем интенсивнее снижается активность фермента. Уменьшение активности АДГобр, вероятно, связано с изменением физиологических особенностей организма после ожога, развитием полиорганной недостаточности, которая, по мнению М.Я. Малаховой, сопровождает ожоговую травму и, возможно, именно обратная реакция алкогольдегидрогеназы наиболее чувствительна к недостаточности кровоснабжения и гипоксии в органах, а также к эндогенной интоксикации организма [7]. Понижение активности АДГобр при термической травме приводит к накоплению во всех исследуемых органах высокотоксичных альдегидов, ацеталей и кетонов. Особенно это характерно для почек, в которых при ожоге при снижении активности АДГобр статистически значимо возрастает активность АДГпр.
Распределение общей активности АДГ в прямой реакции у крыс контрольной группы соответствует литературным данным [10] и уменьшается в ряду: печень → легкие → почки → сердце (рис. 2). У животных с ожогом на 3-и и 7-е сутки после термической травмы наибольшая активность АДГпр регистрируется в легких, затем в почках, в печени и наименьшая в сердце. Преобладание активности фермента в легких по сравнению с другими органами сопровождается более высокими абсолютными значениями удельной активности в легких (табл. 1). На 10-е сутки после ожога активность АДГпр уменьшается в ряду: почки → печень→легкие → сердце. Данное распределение обусловлено нарушением функциональной активности почек из-за избыточного поступления в них токсических веществ и ростом каталитической активности АДГпр.
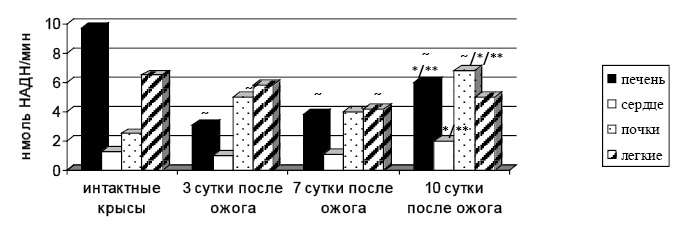
Рис. 2. Общая активность алкогольдегидрогеназы в прямой реакции в норме и при ожоге
~ – статистически значимо по сравнению с интактными крысами (р≤0,05); * – статистически значимо по сравнению с 3-ми сутками (р≤0,05); ** – статистически значимо по сравнению с 7-ми сутками (р≤0,05).
В печени крыс удельная активность АДГпр уменьшается на 26,7 % на 3-и сутки, 64,0 % на 7-е сутки и на 45,5 % на 10-е сутки после ожога по сравнению с контрольной группой крыс, приводя к снижению детоксикационной функции данного органа. Снижение активности АДГ в печени обожженных крыс, вероятно, связано с трансформацией клеточных ультраструктур (митохондрий, рибосом, лизосом). Повреждение митохондрий клеток печени, разобщение в них фосфорилирования и дыхания, возникающие вследствие нарушений кровообращения при ожоге, а также действия токсических веществ, являются причиной изменения активности большинства ферментов данного органа [2, 7].
Кроме структурных и функциональных трансформаций в органах при ожоге, нарушение активности АДГпр происходит и за счет статистически значимых изменений кинетических параметров фермента. В печени выявлено уменьшение сродства АДГпр к субстрату (Kt увеличивается в 1,9 раз на 7-е сутки, в 1,5 раза на 10-е сутки), снижение Кa в 4,0 раза на 3-и и 7-е сутки после поражения. Повышение удельной активности АДГпр в почках (в 2,0 раза на 3-и сутки, в 1,9 и 3,2 раза на 7-е и 10-е сутки) обусловлено снижением Kt в 2,4 раза на 3-и сутки, 1,7 раз на 7-е, в 2,7 раз на 10-е сутки после термической травмы. В сердце удельная активность АДГпр снижается на 51,1 % на 7-е сутки, при этом увеличивается Kt в 1,5 раза (табл. 1, 2). В легких активность АДГпр статистически значимо уменьшается на 22,9 % на 7-е сутки, на 13,5 % на 10-е сутки после ожога по сравнению с интактными животными на фоне роста Kt в 1,5 раза и уменьшения Ka в 2,5 и 3,75 раза на 7-е и 10-е сутки (табл. 2).
Вычисленное соотношение удельных активностей АДГпр/АДГобр у интактных крыс составило: в печени – 0,44, в сердце – 0,26, в почках – 0,31, в легких – 0,70. Полученное значение меньше единицы говорит о преобладании обратной реакции. При термической травме в печени отмечено снижение соотношения на всех исследуемых сутках после ожога, что свидетельствует о накоплении этанола. В сердце, почках и легких на 3-и, 7-е и 10-е сутки после поражения данное соотношение выше показателя интактных крыс, что приводит к повышению высокотоксичных альдегидов.
Таким образом, в печени и легких регистрируется меньшее падение активности АДГобр (< 60 %) на всех сутках после ожога, по сравнению с уменьшением активности в почках (> 60 %, кроме 10-х суток) и сердце (> 60 %). Показано, что статистически значимое изменение удельной активности АДГпр после термической травмы происходит лишь в органах, принимающих наибольшее участие в нейтрализации токсинов – в печени и почках.



