В настоящее время в связи с ростом риска сердечно-сосудистых заболеваний и, как следствие, развитием инсультов и инфарктов, не ослабевает интерес к исследованию путей иннервации кровеносных сосудов головного мозга [5]. Однако способы и механизмы инактивации нейромедиаторов в области нейро-вазальных синапсов на сегодняшний день изучены недостаточно. Согласно современным представлениям существует три способа инактивации медиатора: диффузия из синаптической щели; обратный захват пресинаптическим окончанием и ферментативная деградация. Смит А.Д. [6, 7] в опытах с исследованием перфузатов после электрической стимуляции адренергических нервов показал, что вместе с норадреналином из аксонов выводится пропорциональное количество белков синаптических мембран: хромогранина и дофамин – β-гидролазы, в то время как цитоплазматические белки, например ДОФА – декарбоксилаза, в перфузате не обнаруживаются. Процесс высвобождения целых адренергических везикул из нервных окончаний и их миграция к мышечным клеткам исследован и описан нами ранее [4].
Цель исследования
Изучить механизм инактивации нервного медиатора в сосудах головного мозга различных видов птиц.
Материалы и методы исследования
Исследовали среднюю мозговую артерию и ее ветви у птиц: Сизого голубя (Columba livia), кур породы белый леггорн (Gallus domestica), Большеклювой вороны (Corvus levaillantii), Тихоокеанской морской чайки (Larus schistisagus), Уссурийского баклана (Phalacrocorax filamentosus). Для ультраструктурных исследований сосуды обрабатывали классическим методом фиксации. Срезы готовили на ультрамикротоме LKB-3 и просматривали в электронном микроскопе JEM-100.
Результаты исследования и их обсуждение
Нами установлено, что адренергические нервные волокна располагаются в наружной оболочке средней мозговой артерии на различном расстоянии, которое варьируется от 330 до 4000 нм. Наряду с этим встречаются терминали, которые располагаются в нескольких десятках (40–80) нанометров от гладких миоцитов и осуществляют непосредственное воздействие на миоциты. Адренергические окончания, находящиеся на расстоянии 100–440 нм от наружного слоя миоцитов средней оболочки сосуда, выделяют целые синаптические пузырьки. Медиатор распространяется и доходит до многих клеток, осуществляя дистантную трансмиссию. Мембрана везикулы защищает медиатор от действия экстранейрональных механизмов инактивации на всем пути миграции до гладких мышечных клеток. Отмечено, что везикулы, содержащие норадреналин, проникают внутрь цитоплазмы гладких мышечных клеток путем пиноцитоза, после чего группируются и сливаются в неоднородные глобулы, которые располагаются вблизи ядра клетки (рис. 1).
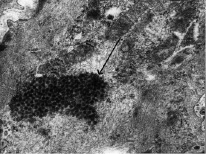
Рис. 1. Скопление адренергических пузырьков в гладких мышечных клетках артерии. Ув. 35 000
Способностью накапливать норадреналин внутриклеточно, с преимущественной концентрацией у ядра обладают гладкие мышечные клетки артерий, где имеется плотная адренергическая иннервация. В цитоплазме гладких миоцитов средней оболочки артерий головного мозга птиц были обнаружены скопления электронноплотных гранул размером 0,49 + 0,0038 мкм (рис. 2).
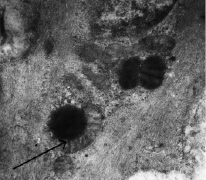
Рис. 2. Соединение наружной оболочки митохондрий с гранулой. Ув. 35 000
К местам скопления глобул подходят митохондрии, размеры которых колеблются от 0,5 до 1 мкм. Известно, что наружная мембрана митохондрий содержит фермент моноаминоксидазу (МАО) [1]. В результате плотное содержимое глобул уменьшается в объеме, они становятся наполовину электронносветлыми. Можно предположить, что в цитоплазме гладких мышечных клеток происходит расщепление норадреналина и перевод его в метаболиты, практически не обладающие биологической активностью (рис. 3).
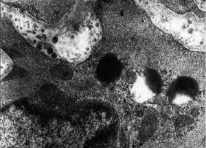
Рис. 3. Исчезновение плотности гранул. Ув. 35 000
В то же время, нами выявлены отдельные синаптические везикулы, которые проникают через все пять – шесть слоев гладких миоцитов средней оболочки и подходят к эндотелиальным клеткам. Синаптические пузырьки, содержащие норадреналин, проходят через цитоплазму эндотелиальных клеток или через межэндотелиальные контакты и оказываются в просвете сосуда (рис. 4).
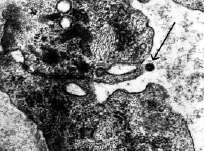
Рис. 4. Выход адренергического пузырька через эндотелий сосудов в кровь. Ув. 35 000
Такой путь норадреналина, заключенного в синаптическую мембрану, можно рассмотреть как путь поступления его в кровь.
Опыты Су и Бэван [8] с меченным Н3-НА показали, что при инкубации аорты кролика в этом растворе, 30 % меченых веществ возвращается в просвет сосуда, а при нервной стимуляции – до 50 % вышедшего в кровь вещества содержит неизменённый норадреналин. Более того, полученные нами данные, позволяют предположить, что массовый выброс везикул норадреналина активирует интактный эндотелий артерии через взаимодействие со специфическими рецепторами, расположенными на поверхности эндотелиальных клеток. Существует мнение, что взаимодействие эндотелиоцитов с такими биологически активными веществами как ацетилхолин, кинины, серотонин, катехоламины и другие активируют фермент NO-синтазу, под влиянием которого из L-аргинина образуется оксид азота, который обладает вазодилататорными свойствами [2, 3]. На основании наших исследований можно предположить, что при массовом выбросе нейромедиатора существует еще один путь инактивации норадреналина с компенсаторно-приспособительным эффектом, который выражается в трансформации вазоконстрикторных свойств адреналина в вазодилататорные способности оксида азота через взаимодействие с рецепторным аппаратом эндотелиоцитов.
Заключение
По нашему мнению, наряду с традиционными путями утилизации избыточного нейромедиатора при помощи мембранных ферментов митохондрий (МАО) или ферментов цитоплазмы (КОМТ) в миоцитах стенки артерии, у птиц ярко выражен компенсаторно-приспособительный механизм инактивации норадреналина. Такой механизм, действуя в экстремальных условиях, позволяет оптимизировать уровень артериального давления в сосудах головного мозга через трансформацию эндотелиоцитами вазоконстриктора-норадреналина в вазодилататор-оксид азота. На основании полученных результатов, можно предположить, что массовое выделение норадреналина, защищенного мембраной, в нейровазальные синапсы головного мозга птиц чаще встречается у активных пернатых (Большеклювой вороны, Тихоокеанской чайки и Уссурийского баклана) или происходит в экстремальных ситуациях для обеспечения надежной адаптивной гемоциркуляции жизненно важных органов.



