Ранее было показано активизирующее влияние низкоинтенсивных электромагнитных излучений миллиметрового диапазона (ЭМИ КВЧ) на механизмы противоопухолевой резистентности [3, 4] при их использовании в соответствии с принципами активационной терапии [2]. Параметры такого воздействия – низкая интенсивность ЭМИ и локализация воздействия преимущественно на голову животных – позволяли говорить об опосредованном характере полученных противоопухолевых эффектов, реализуемых с помощью нейроэндокринных и иммунных механизмов. Результаты анализа цитологических показателей периферической крови и морфофункциональных изменений в органах иммунной системы свидетельствовали о выраженном антистрессорном влиянии ЭМИ КВЧ [3, 4], аналогичном влиянию слабых ЭМИ инфра-низкочастотного диапазона [3, 8]. При этом оставался мало изученным вопрос об изменениях в иммунной системе при регрессии экспериментальных опухолей, отличающихся быстрым развитием и устойчивостью к действию противоопухолевых химиопрепаратов и лучевой терапии.
Целью работы явилось изучение изменений функциональной активности тимуса и лейкоцитов крови крыс с лимфосаркомой Плисса при регрессии опухоли под влиянием низкоинтенсивных модулированных ЭМИ КВЧ.
Материалы и методы исследования
Эксперименты проводили на белых беспородных крысах-самцах 180–260 г разводки вивария РНИОИ. В качестве модели злокачественного процесса использовали лимфосаркому Плисса, штамм которой был получен из Банка опухолевых штаммов Российского онкологического центра им. Н.Н. Блохина РАМН. При перевивке опухоли обычно используемое разведение (до 20 %) было увеличено в 10 раз (до 2 %) с целью удлинения периода выхода опухоли и увеличения времени электромагнитного воздействия на структуры ЦНС до её визуализации. Измерение размеров опухоли проводили ежедневно в связи с быстрыми темпами развития лимфосаркомы Плисса [7]. Объем опухоли определяли по формуле Шрека для эллипсоида.
Воздействие ЭМИ КВЧ начинали за 3–4 дня до перевивки опухолей и продолжали до конца эксперимента. Длительность курса составила 4 недели. Электромагнитное воздействие осуществляли на затылочную область головы животного, находившегося в плексигласовой камере, сконструированной с учетом норкового рефлекса крыс для самофиксации животного. Частотная модуляция сигнала заключалась в электронной перестройке частоты излучения в диапазоне 42,1–42,3 ГГц со скоростью, определяемой частотой модуляции – 7,8 Гц (моночастотная модуляция) или последовательно, 1,7–3,4–7,8–15,6 Гц (поличастотная модуляция). При этом использовались биоэффективные частоты шумановского спектра, а также ранее выявленные частоты магнитного излучения, способствующего развитию антистрессорной реакции повышенной активации у большинства животных [2, 8]. Экспозиция воздействия изменялась в диапазоне 15–30 минут в соответствии с алгоритмами активационной терапии, направленными на развитие антистрессорных адаптационных реакций [2, 4]. Каждая из групп с воздействием ЭМИ КВЧ (моночастотная или поличастотная модуляция – соответственно ЭМИ КВЧ мчм и ЭМИ КВЧ пчм) включала 12 животных, в контрольную группу крыс-опухоленосителей вошло 10 особей, а группа интактных животных состояла из 7 крыс-самцов.
В ходе экспериментов 1–2 раза в неделю проводили определение характера и напряженности общих неспецифических адаптационных реакций организма (АР) по показателям лейкоцитарной формулы периферической крови [2]. В дальнейшем данные цитологического анализа уточнялись с помощью результатов изучения морфофункционального состояния тимуса этих животных [2]. По окончании экспериментов животные умерщвлялись путем эфирной перенаркотизации, фрагменты опухоли, тимус и кровь брали на исследование. Гистологическое и гистохимическое изучение тимуса и фрагментов ткани с места локализации опухоли проводили с использованием окраски гематоксилин-эозином, а также метода Браше в модификации Р.А. Симаковой для выявления нуклеопротеидов. Морфометрию осуществляли по методу Г.Г. Автандилова. При этом в тимусе рассчитывали стромально-паренхиматозный коэффициент, отражавший соотношение элементов стромы и лимфоидной паренхимы, а также определяли наличие контактов тканевых базофилов и тимоцитов (при увеличениях 400 и 900), свидетельствовавшее о межклеточных взаимодействиях в центральном органе иммунной системы.
В лимфоцитах крови оценивали активность ключевых ферментов энергетического обмена – митохондриальных сукцинат дегидрогеназы (СДГ) и α-глицерофосфат дегидрогеназы (α-ГФДГ) [5]. Активность свободнорадикальных процессов определяли по интенсивности перекись-индуцированной люминол-зависимой хемилюминесценции плазмы крови (ХЛ). При статистическом анализе результатов исследования использовали параметрические и непараметрические критерии – t-критерий (Стьюдента) и Z-критерий.
Результаты исследования и их обсуждение
Во всех исследованных группах крыс-опухоленосителей в большинстве случаев (70–75 %) опухоль становилась визуально различимой на 6-й день после перевивки. При этом в течение первых пяти дней после выхода лимфосаркомы Плисса темпы роста опухоли не отличались от этого показателя в контрольной группе животных-опухоленосителей. Исключение составляли 2 животных из группы с воздействием ЭМИ КВЧ пчм, размеры опухолей которых через пять суток после выхода лимфосаркомы Плисса составили 1,6 и 1,7 см3, тогда как у остальных крыс-опухоленосителей к этому времени они достигли размеров 3,5–7,0 см3. Эффект воздействия проявился в регрессии опухоли, полной или частичной. Случаев торможения роста лимфосаркомы Плисса и увеличения сроков жизни по сравнению с показателями в контрольной группе при отсутствии регрессии опухоли отмечено не было. К концу эксперимента пало восемь животных (33 %), у которых воздействие ЭМИ КВЧ оказалось неэффективным, и три крысы (30 %) из контрольной группы.
Регрессия опухолей животных с минимальными размерами лимфосаркомы Плисса из группы ЭМИ КВЧ пчм началась на 6-й день после её выхода. С 8-го дня после визуализации лимфосаркомы Плисса было отмечено начало регрессии значительно более крупных опухолей у 4 крыс из группы ЭМИ КВЧ мчм (5,0–6,3 см3) и у 3 животных из группы ЭМИ КВЧ пчм (11–13,3 см3). В трех последних случаях размеры опухоли уменьшились на 40–50 %, и затем регрессия прекратилась. У крыс же с размерами лимфосаркомы до 6,3 см3 опухоли в течение недели регрессировали на 80–100 % без заметных признаков интоксикации животных. При этом регрессия опухолей сопровождалась формированием капсулы (рисунок).
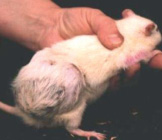
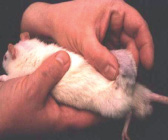
A) Б)
Крысы с лимфосаркомой Плисса при росте и регрессии опухоли. А. Рост опухоли в контрольной группе. Опухоль не отделяется от соседних тканей. Б. Регрессия опухоли под влиянием ЭМИ КВЧ с формированием капсулы. Опухоль легко отделяется от соседних тканей
Таблица 1
Состав групп животных, сформированных по выраженности эффекта ЭМИ КВЧ с разными режимами модуляции
|
Группы/Подгруппы |
ЭМИ КВЧ пчм |
ЭМИ КВЧ мчм |
|
|
Регрессия опухоли |
I. Полная регрессия опухоли, n = 4 |
2 |
2 |
|
II. Регрессия опухоли на 40–90 %, n = 5 |
3 |
2 |
|
|
Рост опухоли, n = 7 |
4 |
3 |
|
Примечание. ЭМИ КВЧ пчм, ЭМИ КВЧ мчм – воздействие ЭМИ КВЧ, соответственно, с поли- и моночастотной модуляцией высокочастотного сигнала.
Таким образом, к концу эксперимента полная или частичная регрессия лимфосаркомы Плисса под влиянием ЭМИ КВЧ с различными режимами модуляции произошла более чем у трети животных – у 9 из 24 крыс (37 %). Такой результат был весьма необычен для лимфосаркомы Плисса, отличающейся устойчивостью к действию специальных противоопухолевых факторов при размерах опухолей, значительно меньших (до 1 см3) по сравнению с исходными размерами регрессировавших опухолей [7]. В связи с этим отмеченные случаи регрессии представляли значительный интерес.
Для анализа изменений в организме и ткани опухоли при эффективных воздействиях животные с регрессией опухоли под влиянием ЭМИ КВЧ в разных режимах модуляции были объединены в одну группу, состоявшую из 2 подгрупп (табл. 1), отличавшихся по выраженности эффекта и ряду других исследованных показателей. Подгруппа I включала 4 животных с полной регрессией лимфосаркомы Плисса, подтвержденной гистологическим изучением ткани из зоны регрессировавших опухолей. В эту подгруппу вошло 2 крысы c опухолями минимальных размеров на момент начала регрессии из группы с использованием ЭМИ КВЧ пчм и 2 крысы из группы с применением ЭМИ КВЧ мчм. В подгруппу II были включены крысы с регрессией опухоли на 40–90 %: 3 животных из группы ЭМИ КВ пчм с регрессией на 40–50 % наиболее крупных из регрессировавших опухолей (более 10 см3, как было отмечено выше) и 2 крысы из группы c ЭМИ КВЧ мчм с более значительной регрессией опухолей – на 80–90 % (табл. 1).
В табл. 2 представлены данные о структуре АР, оценивавшейся с помощью лейкоцитарной формулы крови в ходе экспериментов и при забое, а также некоторые показатели функциональной активности тимуса животных исследованных групп. Как видно из таблицы, гематологические показатели указывали на преобладание в течение эксперимента у крыс с регрессией лимфосаркомы Плисса антистрессорных АР спокойной и повышенной активации (соответственно, СА и ПА), а у остальных животных-опухоленосителей – АР-стресс (Стр). Воздействие ЭМИ КВЧ способствовало активизации лимфопролиферативных процессов в тимусе, о чем свидетельствовало значительное увеличение весового коэффициента этого органа и достоверное снижение стромально-паренхиматозного коэффициента (СПК) (табл. 2). При этом даже у крыс с ростом опухоли весовой коэффициент тимуса были выше, а СПК – ниже, чем в контрольной группе животных-опухоленосителей. Это позволяло сделать заключение о более высоком уровне реактивности, на котором развивался АР-стресс у таких животных, по сравнению с АР- стресс, отмеченным в контрольной группе крыс-опухоленосителей [2]. Наиболее значительной активностью лимфопролиферативных процессов и выраженностью признаков межклеточных взаимодействий в тимусе отличались крысы из подгруппы I (табл. 2). Таким образом, у этих животных наблюдалось четкое соответствие противоопухолевой эффективности ЭМИ КВЧ и его активизирующего влияния на состояние центрального органа иммунной системы.
Более сложные соотношения изученных показателей были отмечены у крыс с частичной регрессией лимфосаркомы Плисса в подгруппе II. С одной стороны, у животных данной подгруппы, согласно гематологическим показателям, преобладала АР спокойной активации, что свидетельствовало о значительном антистрессорном влиянии воздействия, которое и могло обусловить его противоопухолевый эффект, как это многократно было показано ранее для активационной электромагнитотерапии в эксперименте [2, 4, 8]. Кроме того, в рассматриваемой подгруппе животных, аналогично отмеченному у крыс подгруппы I и в отличие от животных с ростом опухоли, наблюдались признаки активизации межклеточных взаимодействий в тимусе, в целом, несколько менее выраженные, чем в подгруппе I.
С другой стороны, у животных подгруппы II наблюдалась атрофия части долек тимуса, что, очевидно, и обусловило заметное повышение СПК по сравнению с этим показателем у крыс подгруппы I, а также значительное снижение весового коэффициента органа по сравнению с показателями у крыс подгруппы I и животных с отсутствием противоопухолевого эффекта ЭМИ КВЧ (табл. 2). Таким образом, у крыс подгруппы II имело место видимое несоответствие гематологических показателей, свидетельствовавших о развитии АР СА, отличающейся, как известно [2], высоким уровнем лимфопролиферативной активности в органах иммунной системы, и объективных показателей лимфопролиферативной активности в тимусе этих животных.
Дальнейший анализ некоторых характеристик крови у крыс исследованных групп и подгрупп, представленных в табл. 3, позволил дополнить картину изменений, вызванных модулированными ЭМИ КВЧ, и сделать предположение о возможных процессах в иммунной системе, связанных с реализацией противоопухолевых эффектов этих воздействий.
Как видно из таблицы, у крыс обеих подгрупп с регрессией опухоли наблюдалось снижение показателя активности фермента α-глицерофосфат-дегидрогеназы (α-ГФДГ) на 22–29 % по сравнению со значениями в контрольной группе животных-опухоленосителей. При этом подгруппа I отличалась и наиболее низкой активностью другого исследованного фермента – сукцинат-дегидрогеназы (СДГ), тогда как интенсивность свободнорадикальных процессов (ХЛ) и уровень лейкоцитов в крови у крыс этой подгруппы были выше, чем у животных подгруппы II. Подгруппа II, в свою очередь, характеризовалась наиболее низким содержанием лейкоцитов в крови (табл. 3).
По нашему мнению, результаты, представленные в табл. 2 и 3, позволяют предположить фазный характер изменения состояния тимоцитов и лейкоцитов крови при реализации противоопухолевого эффекта модулированного ЭМИ КВЧ, обусловленного активизацией антистрессорных механизмов. Так, акцидентальная инволюция тимуса и снижение содержания лейкоцитов у животных подгруппы II могли явиться следствием миграции тимоцитов, активированных в результате межклеточных взаимодействий, из тимуса в кровь, а затем – из крови в ткани для участия в системных противоопухолевых реакциях. При этом данные литературы позволяют связать отмеченное снижение активности фермента α-ГФДГ в лимфоцитах крови крыс с регрессией опухоли с осуществлением иммунных функций этих клеток [6], а формирование соединительнотканной капсулы при регрессии опухолей – с регуляторной, морфогенетической активностью Т-лимфоцитов, способных стимулировать пролиферацию фибробластов [1]. Состоянию животных подгруппы I, вероятно, соответствовала завершающая фаза процессов в тканях и опухоли, характеризовавшаяся восстановлением пула тимоцитов в крови и тимусе за счет обратной миграции клеток и повышения лимфопролиферативной активности в тимусе. При этом высокая интенсивность свободнорадикальных процессов, отмеченная в крови крыс этой подгруппы, могла быть связана с процессами массовой элиминации клеток опухоли, а низкая активность СДГ – с наиболее значительной реализацией энергетического потенциала лимфоцитов при полной регрессии лимфосаркомы Плисса. Для проверки данного предположения необходимы дальнейшие исследования.
Таким образом, регрессия лимфосаркомы Плисса крупных размеров была обусловлена выраженным антистрессорным влиянием низкоинтенсивных модулированных ЭМИ КВЧ, обусловившим активизацию нейроэндокринной системы и последующую системную мобилизацию высокоэффективных иммунных механизмов с вероятным включением антиген-зависимых процессов и элиминацией клеток опухоли путем апоптоза. Полученные результаты расширяют представления о влиянии низкоинтенсивных модулированных ЭМИ КВЧ на механизмы противоопухолевой резистентности и свидетельствуют о перспективности исследованных воздействий как факторов противоопухолевого лечения.
Таблица 2
Характер преобладавших адаптационных реакций (АР) по показателям лейкоцитарной формулы крови и характеристики морфофункционального состояния тимуса крыс с лимфосаркомой Плисса при воздействии ЭМИ КВЧ
|
Группы, подгруппы |
АР |
Весовой коэффициент |
СПК х100 |
Контакты ТКБ и тимоцитов (число случаев, число контактов в поле зрения) |
|
|
Интактные животные n = 7 |
ПА, СА, |
0,97 ± 0,10 ●◘ |
4,2 ± 0,5 ●◘ |
5 (71 %), до 3–4 в поле зрения ● |
|
|
ЭМИ КВЧ Регрессия опухоли |
подгруппа 1 n = 4 |
ПА, СА |
0,65 ± 0,02 ●◘○ |
4,3 ± 0,1 ●◘ |
4 (100 %) до 4–5 в поле зрения ● |
|
подгруппа 2 n = 5 |
СА |
0,15 ± 0,01 ●○ |
8,2 ± 0,6 ●○ |
5 (100 %) от единичных до 4 в поле зрения, ● |
|
|
ЭМИ КВЧ Рост опухоли n = 7 |
Стр٭ |
0,62 ± 0,08 ●◘ |
10,1 ± 0,9 ●○ |
0 % |
|
|
Контроль n = 7 |
Стр |
0,05 ± 0,04 ◘○ |
20,3 ± 0,009 ◘○ |
0 % |
|
Примечания. Различия по отношению к контролю: ● – р < 0,05–0,01; к подгрупппе 2: ◘ – 0,1 < p < 0,05; к интактным животным: ○ – р < 0,05; t-критерий Стьюдента, Z-критерий. Обозначение. СПК – стромально-паренхиматозный коэффициент, ТКБ – тканевые базофилы, ПА – АР повышенной активации, СА – АР спокойной активации, Стр – АР-стресс, Стр٭ – АР-стресс более высоких уровней реактивности по сравнению с аналогичной АР в контрольной группе.
Таблица 3
Показатели метаболической активности лимфоцитов, уровень лейкоцитов и интенсивность свободнорадикальных процессов в крови крыс с лимфосаркомой Плисса при противоопухолевых эффектах ЭМИ КВЧ
|
Показатель |
Подгруппа 1 n = 6 |
Подгруппа 2 n = 7 |
Контроль n = 7 |
|
|
L (мм3) |
14775 ± 2661 Т◘ |
7750 ± 1143 |
10375 ± 475 Т◘ |
|
|
ХЛ |
15411 ± 365 ◘ |
9747 ± 222 |
13795 ± 2753 |
|
|
Лимфоциты |
СДГ |
9,7 ± 0,6 ●◘ |
13,6 ± 1,0 |
12,1 ± 0,8 |
|
α-ГФДГ |
11,0 ± 0,2 ● |
12,1 ± 0,7 ● |
15,5 ± 1,3 |
|
Примечания. Различия по отношению к контролю: ● – р < 0,05–0,01; к подгруппе 2: Т◘ – 0,1 < p < 0,05; ◘ – р < 0,05–0,01; t-критерий Стьюдента. Обозначение. L – содержание лейкоцитов в крови; ХЛ – перекись-индуцированная люминол-зависимая хемилюминесценция плазмы крови; СДГ, α-ГФДГ – соответственно, показатели активности ферментов СДГ и α-ГФДГ.



