В структуре общей патологии кисти на долю опухолевых и опухолеподобных поражений приходится 3,5–8,2 % клинических наблюдений.
Из всех видов костных опухолей трубчатые кости кисти чаще всего поражают хондромы (70 %) [5]. Согласно международной гистологической классификации костных опухолей ВОЗ 2002 года, хондрома костей относится к доброкачественным хрящеобразующим костным опухолям. В 21,7–68,4 % случаев течение хондроматозного процесса осложняется патологическим переломом пораженной кости кисти, возникающим при незначительной физической нагрузке, зачастую являющимся клиническим дебютом опухоли [7, 10].
В настоящее время в реконструктивно-восстановительной хирургии отдается предпочтение следующим видам оперативных вмешательств: резекции очага поражения в пределах здоровой ткани и замещению сформированного пострезекционного дефекта кортикально-губчатыми аутотрансплантатами [1].
С 1986 г. в РНЦ «ВТО» при лечении больных используют аппарат внешней фиксации, созданный под руководством Г.А. Илизарова (в дальнейшем именуемый «мини-аппарат»), и его различные варианты для чрескостного остеосинтеза костей кисти.
Известно, что хондрома растет экспансивно, обычно не инфильтрируя в ткани [5]. Однако она склонна рецидивировать. По данным различных авторов, рецидивы при оперативном лечении хондромы костей варьируют от 1,4 до 5,7 % [8, 9]. Несмотря на данные о низкой частоте рецидивов хондромы кисти при радикально проведенном оперативном вмешательстве [4], нужно учитывать, что клетки хондромы обладают большой способностью к имплантации [3]. В связи с этим возрастает роль гистологического исследования биопсийного материала пациентов с хондромами кисти как с целью более точной диагностики, так и в плане возможности прогнозирования качества приживления и длительности срока перестройки пластического материала при замещении пострезекционного дефекта, а также развития рецидива.
Цель исследования – на основании результатов морфологического исследования хондром кисти определить рациональный объем оперативного вмешательства, для снижения вероятности рецидива опухоли и создания оптимальных условий для органотипической перестройки костнопластического материала в условиях чрескостного остеосинтеза.
Материалы и методы исследования
В клинике «РНЦ «ВТО им. акад. Г.А. Илизарова» с 1996 по 2012 годы был пролечен 41 больной с доброкачественными опухолевыми и опухолеподобными заболеваниями трубчатых костей кисти. Возраст пациентов составил от 10 до 44 лет, из них – 7 детского возраста, 34 – взрослого.
Внутрикостные резекции очагов поражения трубчатых костей кисти были выполнены у 28 пациентов (62,2 % от всех видов резекций и 68,3 % от общего количества больных). Показанием к данному виду оперативного вмешатеьства было наличие у пациентов внутрикостного (чаще в области диафиза трубчатой кости кисти) очага хрящеобразующей опухоли без вовлечения в патологический процесс суставного конца кости и без выраженных деструктивных изменений кортикального слоя, косметического дефицита кисти, а также наличие стабильного внесуставной локализации патологического перелома без смещения. Больным была выполнена внутрикостная резекция патологического очага в пределах здоровых тканей и замещение пострезекционного дефекта трубчатой кости кисти аутотрансплантатом либо костнопластическим материалом «КоллапАн» в условиях чрескостного остеосинтеза.
У всех пациентов (100 %) пострезекционные дефекты трубчатых костей кисти были замещены, после чего производили демонтаж аппаратов и удаление спиц.
Клинико-рентгенологический диагноз был подтвержден гистологически у всех прооперированных пациентов.
В данном исследовании проанализирован резекционный материал, полученный при оперативном лечении 19 пациентов с энхондромами трубчатых костей кисти.
Исследования проводились с соблюдением «Этических принципов проведения научных медицинских исследований с участием человека» и в соответствии с «Правилами клинической практики в Российской Федерации». Все пациенты подписали информационное согласие на публикацию данных проведенных исследований без идентификации личности.
Фрагменты резецированных во время операции тканей фиксировали в 10 %-м растворе нейтрального формалина, декальцинировали [6], дегидратировали в спиртах восходящей концентрации (от 70◦ до абсолютного) и заливали в парафин. Гистологические срезы толщиной 5–7 мкм готовили на санном микротоме фирмы «Reichard» (Германия). Срезы окрашивали гематоксилином Вейгерта и эозином. Световую микроскопию гистологических препаратов осуществляли с использованием микроскопа марки «Микмед-5» фирмы «ЛОМО» (Россия). Получение иллюстративного материала осуществляли путем оцифровывания изображений полей зрения гистологических препаратов с использованием большого исследовательского фотомикроскопа фирмы «Opton» (Германия) и аппаратно-программного комплекса «ДиаМорф» (Россия).
Результаты исследования и их обсуждение
В обозначенных 19 случаях были верифицированы доброкачественные (или зрелые) опухоли, представленные участками гиалинового хряща с выраженным тканевым атипизмом (рис. 1, а, б), граничащие с деструктивно измененной компактной пластинкой. Так как очаг деструкции был локализован внутри кости, опухоли классифицировали как энхондромы.
Резецированные опухоли чаще всего представляли собой образование дольчатой структуры, где гиалиновая хрящевая ткань была разделена прослойками плотной соединительной ткани, граничащей с трабекулами губчатой кости. Дольчатость строения в литературе объясняется диффузным типом питания хондромы [5].
Фрагменты хрящевой ткани состояли из беспорядочно расположенных зрелых хондроцитов, заключенных в основное вещество, окрашенное чаще всего слабо базофильно.
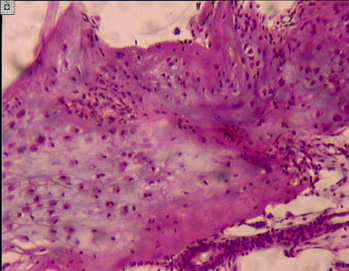
У некоторых пациентов наблюдали выраженную базофилию межклеточного вещества, что свидетельствовало о малом содержании в матриксе хряща кислых и слабокислых гликозаминоглианов. Нарушалась его гомогенность. Отмечали умеренный полиморфизм клеточного состава (рис. 2, а–в).
Если участок опухоли был окружен капсулой соединительнотканного строения – в составе хондромного образования чаще определялись клетки веретеновидной формы (рис. 3, а, б).
Хондроциты содержали объемное эллипсовидное ядро и оксифильную цитоплазму, были радиально расположены внутри каждой дольки.
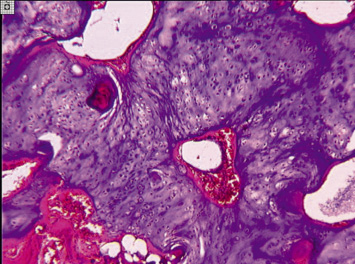
а) б)
Рис. 1. Участки очагов деструкции, обнаруженные на уровне основной фаланги V пястной кости правой кисти (А); на уровне IV пястной кости левой кисти (Б). Препараты окрашены гематоксилином и эозином. Увеличение: А – 25х; Б – 40х

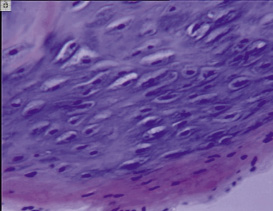
а) б) в)
Рис. 2. Разная выраженность базофилии межклеточного матрикса, полиморфизм хрящевых клеток. Препараты окрашены гематоксилином и эозином. Увеличение: а, б – 63х; в – 160х
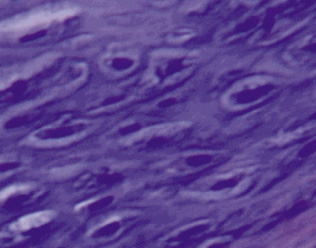
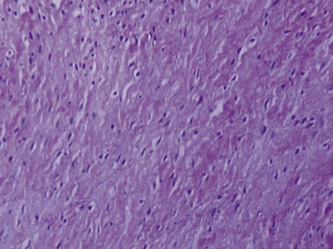
а) б)
Рис. 3. Состав хондромного образования, ограниченного соединительнотканной капсулой: а – хрящевые клетки веретеновидной формы; б – соединительная ткань капсулы хондромы. Препараты окрашены гематоксилином и эозином. Увеличение: а – 400х; б – 100х
Плотность хондроцитов в отдельных участках опухоли была различной. В плане прогноза малигнизации хондромы – этот вариант опухоли, контактно изолированной от окружающих тканей бессосудистой волокнистой соединительной тканью, является благоприятным, так как создается определенный тканевой барьер между опухолью и индуцирующими ее рост факторами внутренней среды организма, препятствующий миграции новых малодифференцированных клеток [5].
Независимо от возраста пациентов, в составе каждой доли опухолевого образования размеры и количество хондроцитов сильно варьировались. В центральных областях опухоли определяли как более крупные одиночные клетки, так и 2-, 3-, 4-членные изогенные группы гипертрофированных хондроцитов с вакуолизированной цитоплазмой. Степень дифференцированности хондроцитов повышалась от центра доли опухоли к периферии.


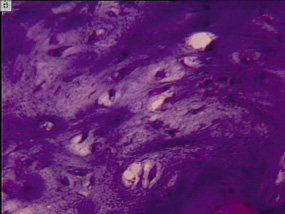
а) б)
Рис. 4. Различные картины деструктивного перерождения тканей в области формирования энхондромы: а – слизистое перерождение межуточной субстанции, б – участки деструктурированной субстанции, очаги некроза. Препараты окрашены гематоксилином и эозином. Увеличение – 400х
Встречались участки деструктурированной субстанции, очаги некроза (рис. 4, б). Своеобразная вариабельность строения хондром, которую мы наблюдали в своих исследованиях, описана и в работе K. Tarigava [10], отмечающего, что такие морфологические особенности характерны только для хондром кисти и стопы.
Участки хрящевой ткани опухоли, граничащие непосредственно с губчатой костью в месте перехода, отличались большей базофильной окраской, хрящевые клетки располагались достаточно плотно, без образования изогенных групп (рис. 5, а). Ткань, формирующаяся на границе с хондромой, имела промежуточное строение между остеоидом и хондроидом. Межклеточный матрикс был окрашен достаточно гомогенно.



а) б) в)



г) д) е)
Рис. 5. Гистоструктурные особенности зоны перехода опухоли в прилегающие ткани и в корковом слое пястных костей, непосредственно прилежащих к очагу деструкции: а – граница собственно костной ткани кортикальной пластинки фаланги пальца кисти и хондромы; б – измененная костная ткань; в – малодифференцированные клетки, с признаками остеогенной дифференцировки; г – выраженность остеопороза; д – участки некроза и лизиса костной ткани; е – участок пластинчатой костной ткани кортикальной пластинки (крайняя область резекции). Препараты окрашены гематоксилином и эозином. Увеличение: а, д, е – 63х; б – 400х; в – 1000х
Хрящевые клетки располагались в лакунах, имели чаще округлую форму, и крупное, центрально расположенное ядро, большее либо равное объему, занимаемому цитоплазмой.
Граничащая с зоной гипертрофированных хондроцитов костная ткань отличалась редко расположенными остеоцитами с пикнотически измененными ядрами, находящимися в узких лакунах. В ней обнаруживали большое количество пустых лакун (рис. 5, б). Отсутствие кровеносных сосудов в пограничных зонах, наблюдаемое на препаратах, являлось неблагоприятным фактором в плане замедления прогрессии опухоли.
В более удаленных от опухоли участках кости отмечали клетки, дифференцирующиеся в остеогенном направлении (рис. 5, в).
В некоторых случаях костные трабекулы на границе с соединительнотканной капсулой имели остеоидное строение, образуя трабекулярную сеть и формируя новообразованный слой губчатой кости.
На некоторых гистологических препаратах обнаруживали участки сохраненного эндоста, что, с одной стороны, препятствовало остеонекрозу и сохраняло гомеостаз неорганических веществ, с другой – способствовало активной остеокластической резорбции кортикальной пластинки, обеспечивая разрастание хрящевой ткани, ее экспансию в кость, что в плане развития заболевания являлось неблагоприятным фактором [2].
Встречались случаи атрофии и остеопороза прилежащей кости (рис. 5, г), иногда в ней выявляли фрагменты с признаками некроза (рис. 5, д).
На границе резецированных опухолей в большинстве гистологических препаратов определяли участки неизмененной пластинчатой кости, сохраняющей остеонное строение и имеюших микрососуды (рис. 5, е), что с позиций использования костных трансплантатов и успешности их приживления является перспективным, поскольку сохраняется возможность ангиогенеза и ремоделирования костной ткани (наличие клеток остеобластического и остеокластического дифферонов) на основе имплантата в соответствии с прилагаемыми векторами механической нагрузки [2].
Таким образом, проведенное гистологическое исследование показало, что во всех исследованных случаях обнаружен тканевой атипизм и умеренный клеточный полиморфизм, что характерно для доброкачественных или зрелых опухолей. Выявлено нарушение органо- и гистотипической дифференцировки резецированного участка кости. Дифференцированность структур в хондрогенном направлении, экспансивный рост опухоли, ее внутрикостная локализация позволили верифицировать опухоли как энхондромы.
Отмечено, что остеокластическая резорбция обеспечивает разрастание хрящевой ткани опухоли и ее экспансию в кость, что в плане развития заболевания является неблагоприятным фактором, также как и отсутствие кровеносных сосудов в пограничных зонах (имеется в виду измененная костная ткань).
Изоляция опухоли от окружающих тканей бессосудистой волокнистой соединительнной тканью создает определенный тканевой барьер, препятствующий миграции новых малодифференцированных клеток.
Заключение
В связи с вариативностью гистологической картины резецированной хондромы и обнаруженными выраженными изменениями костной ткани компактной пластинки на границе с хондромой следует, что удаление костной опухоли необходимо осуществлять с захватом неизмененной (интактной) кости (выполнение внутрикостной резекции, а не экскохлеации), что обеспечивает исключение рецидивов заболевания в виде дальнейшего прогрессирования роста хондром, а также является адекватным вариантом подготовки реципиентной зоны пострезекционного дефекта для костнопластического его замещения.



