В структуре гинекологических заболеваний у девочек-подростков первое место занимают нарушения менструальной функции [1]. Наиболее прогностически неблагоприятным из них является вторичная аменорея, частота которой за последние двадцать лет увеличилась почти в два раза [8]. Для практикующего врача весьма важной является возможность предположить на основании клинических данных вероятный механизм возникновения заболевания для выбора оптимальной тактики обследования и лечения больной. В связи с этим разработка математических моделей для определения клинического варианта вторичной аменореи и ведущего гормонально-метаболического фактора в его патогенезе является актуальной.
Целью настоящей работы явилась разработка математических моделей для определения клинического варианта вторичной аменореи и ведущего гормонально-метаболического фактора в его возникновении.
Материалы и методы исследования
Для реализации поставленной цели обследовано 280 девочек 13–17 лет с ВА. Проводилась оценка сомато-полового развития, в том числе определение индекса массы тела (ИМТ) по общепринятой методике, возраста менархе, длительности задержки менструации, характера менструальной функции до возникновения ВА. Всем пациенткам выполняли ультразвуковое исследование органов малого таза и кольпоцитологическое исследование [2, 4]. В сыворотке крови определяли иммуноферментным методом содержание ЛГ, ФСГ (реактивы «Алколор» фирмы Био-Санкт-Петербург, Россия), лептина (реактивы фирмы DRG Instruments GmbH, Германия), радиоиммунохимическим – тестострона (Т), эстрадиола (Э2), пролактина (ПРЛ) инсулина (Ин), сексстероидсвязывающего глобулина (ССГ), инсулиноподобного фактора роста-1 (ИФР–1) радиоиммунным методом (установка «Наркотест, реактивы реактиви «IMMUNOTECH», Чехия). Величину индекса свободного тестостерона (ИСТ) и индекса свободного эстрадиола (ИСЭ) рассчитывали по общепринятым методикам [5, 9].
Для подтверждения корректности выделения трех клинических вариантов ВА использовали дискриминантный анализ, для выделения ведущих факторов в механизмах их возникновения – факторный анализ [3]. Статистическая обработка результатов проводилась с использованием пакета программ «Statgraphics Centurion».
У всех законных представителей больных с ВА и подростков из ГС, а также у девочек, достигших 14-летнего возраста, получены информированные согласия на проведение исследования. Проведение исследования одобрено Комитетом по биоэтике института охраны здоровья детей и подростков НАМН, Харьков, Украина.
Результаты исследования и их обсуждение
При анализе клинических признаков обращала на себя внимание их значительная неоднородность, в первую очередь различный характер менструальной функции до начала ВА – от отсутствия менструаций после менархе до регулярного менструального цикла в течение 1–3 лет. Для объективного распределения больных на различные клинические группы использовали дискриминантный анализ. На основании его результатов было выделено 3 клинических варианта ВА: ВА, возникшая сразу после менархе или через 2–3 месяца после него (ВА І); ВА (ВА ІІ), начавшаяся после других нарушений менструального цикла (нескольких эпизодов олигоменореи или после пубертатного маточного кровотечения) и ВА, наступившая после длительного регулярного менструального цикла (ВА ІІІ). В рамках разработанной математической модели производилось распределение объектов на 3 класса, описываемых двумя дискриминантными функциями (ДФ), при этом корректно выполнялось распределение более 75 % больных. Статистические параметры этой модели представлены в табл. 1.
Различия в координатах центроидов отражены на рисунке.
Значениz классификационных функций для различных клинических вариантов ВА приведены в табл. 2.
Из данных, представленных в табл. 2, следует, что наибольшие межгрупповые различия, по данным коэффициентов классификационных функций, имели такие признаки, как возраст менархе, менструальный возраст, длительность ВА, наличие гирсутизма и тип кольпоцитологического мазка.
Таблица 1
Статистическая характеристика модели классификации объектов
|
Дискриминантная функция |
Информативность, % |
Каноническая корреляция |
Критерий χ2 |
Статистическая значимость, Р |
|
ДФ1 |
85,03 |
0,69963 |
224,4687 |
0,0000 |
|
ДФ2 |
14,97 |
0,38001 |
42,2661 |
0,0001 |
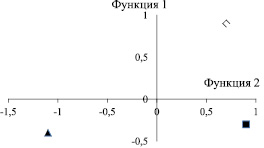
Координаты центроидов в группах с различными клиническими вариантами ВА:  – центроид в группе (ВА І);
– центроид в группе (ВА І);  – центроид в группе (ВА ІІ);
– центроид в группе (ВА ІІ);  – центроид в группе (ВА ІІІ)
– центроид в группе (ВА ІІІ)
Таблица 2
Стандартизированные коэффициенты классификационных функций
|
Клинические признаки (Х) |
ВА І |
ВА ІІ |
ВА ІІІ |
|
Возраст больной (года) |
8,21 |
8,66 |
8,23 |
|
Менархе |
9,17 |
10,25 |
10,64 |
|
Менструальный возраст |
3,15 |
6,88 |
6,32 |
|
Продолжительность ВА |
3,53 |
2,10 |
3,15 |
|
Масса тела |
1,04 |
1,34 |
0,85 |
|
Акне |
–0,77 |
–1,14 |
–1,28 |
|
Гирсутизм |
–0,38 |
0,28 |
–0,22 |
|
Балл развития вторичных половых признаков |
9,69 |
10,43 |
10,17 |
|
Гипоэстрогения |
2,11 |
1,20 |
1,14 |
|
Несоответствие размеров матки степени эстрогенной насыщенности организма |
3,22 |
3,76 |
4,33 |
|
Гипоплазия матки (по данным УЗИ) |
1,98 |
2,70 |
1,69 |
|
Наличие М-эхо ( по данным УЗИ) |
2,15 |
2,07 |
2,46 |
|
Структура яичников (по данным УЗИ) |
4,13 |
3,66 |
4,39 |
|
Константа |
–40,13 |
–47,23 |
–45,87 |
В факторной модели для ВА І, в фактор І, включающий в себя 24,9 % общей дисперсии, вошли свободные фракции эстрадиола и тестостерона. Следует отметить, что факторная загрузка (ФН) для ИСЭ (ФН 0,86) превышала факторную нагрузку для ИСТ (ФН 0,80), что говорит о более высокой корреляции ИСЭ с фактором І. С учетом полученных нами ранее данных о высокой частоте нормоэстрогенемии и наличии гипоплазии матки у большинства больных, можно предположить, что фактор І дополнительно отображает влияние нарушений рецепторов эстрадиола на возникновение заболевания [6, 7].
В фактор II, включающий в себя 19,5 % общей дисперсии, вошли ІФР-1 (с расположением на отрицательном полюсе фактора (ФН –0,90)) и лептин (с расположением на положительном полюсе фактора (ФН 0,73)). Полученные данные совпадают с литературными данными о наличии обратной святи между ІФР-1 и лептином [10]. Фактор II можно рассматривать как характеризующий энергообоспечение ростовых процессов в организме.
Фактор ІІІ, включающий в себя 16,6 % общей дисперсии, отображает вклад нарушений гонадотропной функции гипофиза, так как в его состав вошли ЛГ (ФН 0,84) и ФСГ (ФН 0,47) со значимыми факторными нагрузками.
Факторная модель для ВА ІІ включала в себя 3 фактора. Фактор І охватывал 39,9 % общей дисперсии. Учитывая высокую факторную нагрузку для ИСТ (ФН 0,87) и инсулина (ФН 0,78) и значительно меньшую для ИСЭ (ФН 0,73), можно говорить о ведущей роли гиперандрогении в формировании этого клинического варианта ВА, что сочетается с высокой распространенностью гирсутного синдрома у этих больных [6]. Наличие лептина в составе фактора І (ФН 0,85) подтверждает данные о влиянии данного гормона на стероидогенез.
В фактор ІІ, включающий в себя 17,6 % общей дисперсии, вошли пролактин (ФН 0,71) и тестостерон (ФН 0,80). Данный фактор подчеркивает значимость андрогенов в развитии ВА ІІ и может отражать возможное влияние пролактина на их синтез.
В фактор ІІІ, включающий в себя 11,8 % общей дисперсии, вошли ІФР-1 (ФН 0,89), ЛГ (ФН 0,62) и ФСГ (ФН 0,62), что характеризует его как отображающий нарушения гонадотропной функции и влияние на нее уровня ІФР-1.
В модели, построенной для ВА ІІІ, в фактор І, включающий в себя 42,9 % общей дисперсии, вошли ІФР-1 (ФН 0,88) и лептин (ФН 0,88), потому можно говорить о том, что он отражает состояние энергетического метаболизма. Ведущая роль данного фактора может быть обусловлена тем, что 90 % девочек-подростков с данным клиническим вариантом ВА ограничивали себя в еде, что нередко сочеталось с активними занятиями спортом [6].
Фактор ІІ, включающий в себя 21,9 % общей дисперсии, указывал на важную роль не только гонадотропной, но и пролактинобразующей функции гипофиза (ПРЛ, ФН 0,89). Расположение на разных полюсах фактора ЛГ (ФН –0,81) и ФСГ (ФН 0,73) отражает вклад дисгонадотропинемии в генезе заболевания у данного контингента больных.
В фактор ІІІ, охватывающий 17,3 % общей дисперсии и отражающий нарушения стероидогенеза, вошли ИСЭ (ФН 0,95) и ИСТ (ФН 0,36).
Таким образом, результаты исследований свидетельствуют о возможности выделения трех клинических вариантов вторичной аменореи. При этом одним из ведущих факторов возникновения вторичной аменореи, которая началась сразу после менархе, является несостоятельность рецепторного аппарата матки. В формировании вторичной аменореи, возникшей после других нарушений менструального цикла, важная роль принадлежит гиперандрогении. В основе возникновения вторичной аменореи, развившейся после длительного периода менструального цикла, как правило, лежит нарушение энергетического баланса организма.



