В настоящее время активно разрабатываются новые способы доставки ЛС с целью увеличения их биодоступности [6, 8]. Одной из таких систем являются фитосомы. В этих структурах водорастворимые растительные компоненты вступают в реакцию с фосфолипидами, при достижении равновесия между гидрофильными и гидрофобными радикалами, увеличивается способность преодоления липидного слоя клеточных мембран и растворения в желудочно-кишечных жидкостях [5].
Особый интерес представляют фитосомы с флавоноидами из-за широкого спектра фармакологической активности этих соединений. Однако гидрофильность данного класса существенно снижает их проницаемость через кожный барьер и всасывание в ЖКТ, следовательно, снижается биодоступность флавоноидов и оказываемый эффект [1].
Целью настоящего исследования стало информационно-аналитическое исследование свойств, способов получения и применения новой лекарственной формы – фитосомы.
Результаты исследования и их обсуждение
Строение и назначение фитосомы. Название «фитосома» недаром созвучно с «липосома». В состав обеих лекарственных форм входят липиды, однако строение фитосом существенно отличается от липосомальных лекарственных форм. В структуре липосомы активное вещество либо растворено внутри фосфолипидного «шарика», либо находится в слое мембраны, а также может быть конъюгировано на поверхности мембраны [16, 21]. Фитосома отличается от липосомы тем, что фитокомпонент ковалентно связан с полярной головкой фосфолипидов, являясь неотъемлемой частью мембраны. Некоторые липосомальные препараты действуют в водной среде или буферном растворе, тогда как фитосомы активны с растворителями, имеющими низкую диэлектрическую проницаемость [17, 18, 20].
Обобщая литературные данные, можно дать следующее определение понятию фитосома – это флавоноидная молекула, связанную по крайней мере с одной молекулой фосфатидилхолина. Она является молекулой-гибридом, обладающей высокой растворимостью в липидной и в водной средах. В водных средах фитосомы группируются в мицеллу [8, 10, 22].
Несмотря на разницу в строении, сходство фитосомы и липосомы проявляется в их предназначении. Как и липосома, фитосома используется для увеличения биодоступности лекарственного компонента, более направленной доставки, повышения эффективности действия и снижения терапевтической дозы лекарства [5, 16].
В фитосоме активное вещество хорошо преодолевает кожный барьер и предотвращает разрушение фитокомпонентов под действием пищеварительных ферментов и кишечных бактерий. Это приводит к улучшению терапевтической эффективности. Следовательно, дозы, требуемые для достижения желаемого эффекта, также снижаются [20].
На сегодняшний день известны фитосомы с экстрактами гинкго билоба, расторопши, виноградных косточек, боярышника, зеленого чая и женьшеня. Флавоноидные и терпеноидные соединения этих экстрактов хорошо связываются с фосфатидилхолином [5, 18, 19].
Эффективность фитосомальных лекарственных форм доказана клинически. Так, например, гепатопротекторные свойства плодов расторопши пятнистой связаны с присутствием в них силибина [9], который, однако, имеет ограниченную биодоступность. Были проведены клинические испытания силибина в виде фитосомы дозировкой от 240 до 360 мг в течение 150 дней [12]. В качестве контроля использовали «плацебо» (n = 117) или силибин вне комплекса (n = 49). Для оценки клинического действия были изучены энзимные уровни аспартат-аминотрансферазы (AST), аланин-аминотрансферазы (ALT) и гамма-глутамилтранспептидазы (GGT). Исследователи пришли к выводу, что фитосомальная форма силибина оказывает значительно более выраженный клинический эффект [16].
Способ получения фитосомы. Технология получения фитосом предполагает включение фосфолипидов (таких как фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин) в стандартизованные растительные экстракты [5, 16].
Фитосомы получают реакцией взаимодействия между 1–2 молями фосфолипида с 1 молем активного растительного компонента (флавоноиды или терпеноиды) в апротонном растворителе (диоксан, ацетон, метиленхлорид, этилацетат). Затем комплекс выделяют путем выпаривания растворителя в вакууме или осаждением с реагентом, таким как алифатические углеводороды, путем лиофилизации или методом распылительной сушки. Наиболее оптимальное соотношение компонентов в фитосоме 1:1 [5, 10, 19].
В литературе встречается ряд методик получения фитосом. Например, для образования комплекса силимарина с соевым фосфатидилхолином 1:1 поступают следующим образом: к раствору 5 г силимарина в 100 мл ацетона добавляют 8 г реактива «Липоид S 100 (R)», при перемешивании при комнатной температуре. После полной солюбилизации реакционную смесь концентрируют в вакууме до объема 30 мл и приливают к 300 мл лигроина, при перемешивании. Осадок отстаивают в течение ночи, затем его отделяют фильтрованием, промывают лигроином и сушат в вакууме при 40 °С. Выход составляет 11,2 г комплекса. При изучении спектральных характеристик полученного фитосомального комплекса было установлено, что удельный показатель поглощения составляет 170,2 при 288 нм (растворитель – метанол) [7].
Вторым примером может служить методика получения фитосомы силибина с соевым фосфатидилхолином в соотношении 1:2. К суспензии, содержащей 4,82 г (0,010 моль) силибина в 75 мл диоксана, добавляют при перемешивании 15,4 г (0,020 моль) «Липоид S 100 (R)». Через 4 часа реакционную смесь лиофилизируют. Выход составил 20 г комплекса светло-желтого цвета с удельным показателем поглощения, равным 106 при 288 нм в растворе метанола [7].
Для получения комплекса силибина с соевым фосфатидилхолином 1:0,3 раствор силибина в диоксане (2,41 г (0,005 моль) силибина на 100 мл диоксана) обрабатывают при 60 °С реактивом «Липоид S 100 (R)» массой 0,770 г (0,001 моль) в течение 1 часа. Реакционную смесь упаривают досуха в вакууме и остаток переносят в 100 мл хлороформа. Избыток силибина, присутствующий в виде осадка, удаляют фильтрованием, а маточный раствор, содержащий комплекс, выпаривают досуха в вакууме. Полученный остаток сушат при 30 °С под вакуумом. Выход составляет 2,3 г комплекса в виде белого желтоватого порошка. Удельный показатель поглощения метанольного раствора полученного комплекса равен 300 при 288 нм (CH3OH) [7].
Методика получения фитосомы экстракта гинкго билоба с соевым фосфатидилсерином заключается в следующем: 1,87 кг 20 % фосфатидилсерина суспендируют в 17,5 л этилацетата при комнатной температуре. Добавляют сухой экстракт гинкго билоба (0,65 кг) и перемешивают. Суспензию выдерживают в течение 1 часа при перемешивании при кипячении с обратным холодильником, затем фильтруют при 70–75 °C и концентрируют при давлении окружающей среды до получения мягкого осадка. Осадок сушат при 40 °C в течение 48 часов. Выход продукта: 2,23 кг комплекса экстракт гинкго билоба – фосфатидилсерин [3].
Интерес представляют фитосомы с индивидуальными флавоноидами, поскольку из-за разнообразия фармакологических эффектов этих соединений можно существенно расширить ассортимент лекарственных средств, обладающих хорошей биодоступностью.
Фитосомы кверцетина с фосфатидилхолином и холестерином получают с использованием метода тонкослойной гидратации с различным молярным отношением кверцетина, фосфатидилхолина и холестерина. Кверцетин и фосфатидилхолин растворяют в метаноле, а холестерин – в дихлорметане. Смесь помещают в круглодонную колбу и упаривают на роторном испарителе при 45 °С до образования пленки. Затем с помощью вакуумной сушки полностью удаляют органические растворители. Дополнительно готовый липидный тонкий слой подвергают воздействию потока газообразного азота и выдерживают в течение ночи при комнатной температуре, чтобы обеспечить полное удаление органических растворителей. Пленку увлажняют дистиллированной водой в роторном аппарате при 45 °С. Для уменьшения размера фитосомы применяют: диспергирование в ультразвуковой ванне при 45 °С, гомогенизацию в центрифуге с 20000 оборотов в минуту и метод ультразвуковой обработки [11, 12].
Физико-химическая оценка фитосом. Фитосомы можно охарактеризовать по форме, размеру, плотности распределения, % связанного вещества в объеме, количеству высвобождаемого вещества, стабильности [2, 6, 15].
В литературе встречается пример оценки свойств кверцетин-фосфатидилхолин-холестеринового фитосомального комплекса. Средний размер частиц фитосом, полученных при молярных соотношениях 1: 2: 0 и 1: 2: 0,2 кверцетина : фосфатидилхолина : холестерина, составил 79 нм и 82 нм соответственно. Анализ частиц, проведенный на приборе Malvern, Nano series, S90 Zetasizer, Великобритания, показал узкое распределение. При увеличении концентрации холестерина увеличивалась и толщина липидного бислоя. По результатам исследования эффективность инкапсуляции кверцетина в фитосоме была в пределах 96–98 % и не менялась в зависимости от изменений молярных соотношений компонентов системы. Анализ показал, что при добавлении холестерина стабильность фитосом возрастает за счет ограничения ацильных цепей фосфатидилхолина [9, 15].
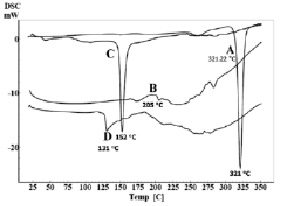
ДСК-термограмма чистого кверцетина (A), фосфатидилхолина (В), холестерина (С) и фитосомального комплекса (D)
Удельную теплоту плавления определяли с помощью дифференциального сканирующего калориметра (DSC 60, Shimadzu, Япония) [15]. Дифференциальные сканирующие (ДСК) термограммы чистого кверцетина, холестерина, фосфатидилхолина и фитосомального комплекса показаны на рисунке. Эндотермический пик кверцетина наблюдался в 321.22 °C (рисунок, А), соответствующий его точке плавления. ДСК-термограмма фосфатидилхолина и холестерина также показали эндотермические пики при 205 °С и 152.45 °С соответственно (рисунок, B, C). Термограмма фитосомального комплекса (рисунок, D) показала исчезновение эндотермического пика плавления кверцетина и значительное смещение эндотермического пика плавления холестерина в нижних точках плавления. Эти наблюдения показали, что кверцетин был молекулярно распределен на поверхности и внутри матрицы фитосомы и утратил свою кристаллическую структуру. Кверцетин и фосфатидилхолин образуют водородные связи между гидроксильными группами кверцетина и полярной части фосфатидилхолина [2, 15].
В литературе встречаются примеры определения удельной температуры плавления рутин-фосфатидилхолинового комплекса с помощью прибора Perkin Elmer JADE DSC, США. Также данный комплекс исследовали с помощью ИК-спектроскопии на Alpha FT-IR спектрофотометре (Bruker, Германия), образец исследовали на просвечивающем электронном микроскопе JEOL (JEM 2100), Япония [4, 13].
Выводы
1. По сравнению с традиционными лекарственными растительными формами фитосомы наиболее перспективны в доставке растительных экстрактов, т.к. абсорбция и биодоступность водорастворимых компонентов возрастает благодаря их взаимодействию с фосфолипидами.
2. В литературе присутствуют данные о фитосомах, содержащих преимущественно растительные экстракты, богатые флавоноидами, или индивидуальные флавоноиды. Однако данные о возможности включения других растительных гидрофильных, мало растворимых в воде соединений в липидные комплексы, отсутствуют. Это открывает широкие перспективы для исследователей в разработке методов получения новых фитосомальных комплексов.
3. Фитосомы – как лекарственная форма – новое, только развивающееся направление. Для его правильного становления необходима разработка единых подходов к оценке качества фитосом. В существующих литературных примерах методы физико-химической оценки этой лекарственной формы представлены крайне скудно или вовсе отсутствуют.



