О- и N-замещенные карбаматы интенсивно исследуются в качестве пролекарств [42–50], генерирующих в процессе метаболизма биологически активные фенолы и амины. С целью защиты исходных фенолов синтезированы эфиры карбаминовой кислоты на основе 5-замещенных 8-хлор-7-гидрокси-3-метил-2,3,4,5-тетрагидро-1Н-3-бензазепинов, относящиеся к классу допаминергических препаратов, и изучены в качестве пролекарств, образующие фенолы в результате первичного метаболизма при пероральном введении [44]. Найдено, что монозамещенные карбаматы являются нестабильными соединениями при рН 7,4 и 37 °С, их период полураспада составил 4–40 мин. В то же время N,N-дизамещенные карбаматы оказались устойчивыми к гидролизу как в буферных растворах, так и в плазме. Они проявили высокую способность к ингибированию бутирилхолинэстеразы, но оказались менее мощными ингибиторами ацетилхолинэстеразы эритроцитов. In vitro N,N-дизамещенные карбаматы в присутствии микросом печени мыши и крысы превращались в заметных количествах в исходные фенолы. Метаболизм карбаматов, вероятно, происходит через стадию гидроксилирования при участии цитохрома Р-450 с образованием N-гидроксиметильного производного, которое самопроизвольно распадается до N-монометилкарбамата. На основании проведенного исследования авторы данной работы сделали вывод, что изученные N,N-дизамещенные карбаматы являются потенциальными пролекарствами 7-гидрокси-3-бензазепинов.
Торберг с сотр. [49] синтезировали ряд защищенных фенолов и протестировали их в качестве допаминергических пролекарств, при этом карбаматные эфиры оказались наиболее подходящими для этих целей.
Карбаматная связь по сравнению со сложноэфирной связью является более устойчивой в плазме, что обуславливает высокую вероятность конъюгата достигать мишени [43, 44]. Камптотецин и комбретастатин были присоединены к аналогу пептидов, соматостатину, с использованием карбаматной связи между лекарством и линкером. Линкер, в свою очередь, содержал метил-аминометильный фрагмент, который присоединялся к карбаматному атому азота. В результате атаки вторичного амина по карбонильному атому углерода карбаматной группировки происходит образование пятичленной циклической мочевины и освобождение лекарства. Величина PKa гидроксильной группы при этом оказывает существенное влияние на скорость освобождения лекарства из конъюгата. Конъюгат камптотецина проявил высокую цитотоксичность по отношению к раковым клеткам нейробластомы линии IMR32.
Авторы статьи [43] приводят результаты изучения ингибирования роста клеток опухоли при использовании доксазолидиновых карбаматов в качестве пролекарств. Карбаматы синтезировались и применялись с целью селективного гидролиза их карбоксиэстеразами человека и высвобождения доксазолидина (Doxaz), формальдегида-оксазолидин доксорубицина, что приводит к кросс-связыванию ДНК и гибели опухолевых клеток.
Проведен анализ литературных данных по гидролизу карбаматов, применяемых в качестве лекарств, с целью выявления количественных соотношений между молекулярной структурой и лабильностью метаболитического гидролиза [50]. Установлено, что метаболитическая активность карбаматов уменьшается в следующем ряду: арил-OCO-алкил NHAlkyl >> –OCO-NHAlkyl ~ алкил-OCO-N(алкил)2 ≥ алкил-OCO-N (эндоциклическая) ≥ арил-OCO-N (алкил) 2 ~ арил-OCO-N (эндоциклическая) ≥ алкил-OCO-NHAryl ~ алкил-OCO-алкилNHAcyl >> –OCO-NH2 > циклические карбаматы. Найденная зависимость может быть полезной при разработке новых карбаматов в качестве лекарств и пролекарств.
Таким образом, синтез новых представителей замещенных ароматических и гетероциклических карбаматов и их производных и последующее изучение их биологической активности и метаболизма является важной и актуальной задачей современной органической и медицинской химии.
В настоящем миниобзоре обобщаются литературные данные по синтезу и дальнейшим химическим превращениям функционально замещенных N-арилкарбаматов, а также изучению их биологической активности.
Реакции электрофильного ароматического замещения в N-замещенных карбаматах и дальнейшая функционализация полученных соединений
Разработаны способы получения нитро-, нитрозо-, хлорметильных производных N-арилкарбаматов. Эти реакции, а также реакции конденсации алкил-N-арилкарбаматов с ароматическими альдегидами иллюстрируют аналогию в химическом поведении с фенолами и простыми эфирами фенолов [2]. В то же время в отличие от фенолов ароматические N-замещенные карбаматы реагируют с дихлоркарбеном в условиях реакции Раймера - Тимана в присутствии межфазного катализатора (триэтилбензиламмонийхлорида) не по бензольному кольцу, а по атому азота карбаматной группы с образованием соответствующих N-формильных производных [3], что объяснено таутомерным превращением карбаматной группы в данных условиях в имидолятную форму.
Найдено, что С-нитро-алкил-N-арилкарбаматы проявляют противомикробные свойства [4]. Нитрозопроизводные N-арилкарбаматов (1) были использованы для получения аминопроизводных N-арилкарбаматов (2), 1,2-оксазинов (3), производных бензимидазола (4, X=H, Na), N-алкоксикарбонилпроизводных п-бензохинондиимина (5) и индола (6), бис(N-n-метоксикарбоксамидофенилнитрона) (7) и других соединений с карбаматным фрагментом [2].
Показано, что 1,2-оксазины (3) и натриевые соли и гидрохлориды таутомерных 5(6)-алкоксикарбоксамидопроизводных 2-арил-1-гидроксибензимидазол-3-оксида (4), полученные на основе нитрозопроизводных N-арилкарбаматов, проявляют высокую противогрибковую активность в отношении ряда микроорганизмов [4, 5, 39], обладают противоишемическим действием [6, 7], а 1,2-оксазины с карбаматной функцией, а также триазены, полученные конденсацией изониазида с нитрозопроизводными карбаматов, проявляют значительную антимикобактериальную активность в отношении M. lufu и M. tuberculosis [8, 9].
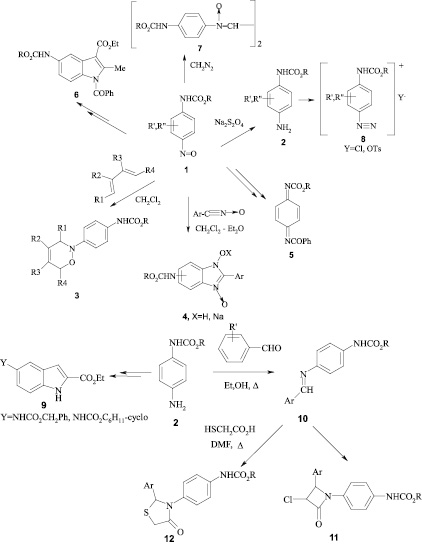
Аминопроизводные карбаматов (2) были превращены в тозилатные и хлоридные соли арилдиазония (8), 1,3-незамещенные производные индола (9) с карбаматной функцией при С5, основания Шиффа (10), а также производные 4-оксоазетидина (11) и 1,3-тиазолидинона-4 (12) с фенилкарбаматным фрагментом [10].
Синтез гетероциклических соединений на основе гидроксизамещенных N-арилкарбаматов
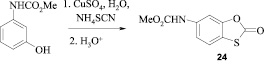
На основе гидроксизамещенных карбаматов были получены производные 1,4-бензоксазина (13, 14) [11], метил-N-[3-(3-R-амино-2-гидроксипропокси)фенил]карбаматы [12], производные 2Н-хромена (15-20), 4Н-хромена (21) [13, 14], дигидрокумарина (22) [38], бензофурана (23), а также производные бензо[d][1,3]оксатиол-2-она (24) и алкоксифенилкарбаматов. Среди О-алкиламинопроизводных карбаматов найдены вещества с гипо- и гипертензивной активностью [15].
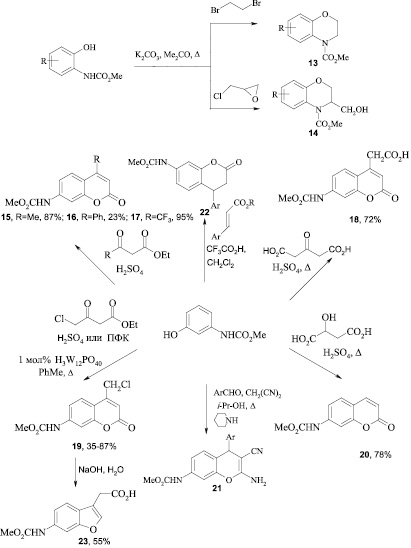
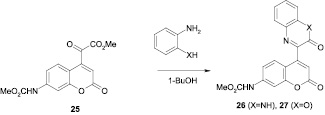
Атом хлора в производном 19 легко замещается на морфолиновый остаток в безводном диоксане при 20 °С в течение 24 ч с образованием метил N-[4-(морфолинометил)-2-оксо-2Н-хромен-7-ил]карбамата. Окислением метильной группы соединения 15 диоксидом селена получен соответствующий альдегид. Нагреванием хромена 18 с метанолом в присутствии каталитического количества n-толуолсульфокислоты получен соответствующий сложный эфир, метиленовая группа которого была превращена в оксогруппу при окислении диоксидом селена с получением a-кетоэфира 25.
Конденсацией соединения 25 с о-фенилендиамином и о-аминофенолом получены производные хромена с 3-оксо-3,4-дигидро-2-хиноксалиновым (26) и 2-оксо-2Н-1,4-бензоксазиновым (27) фрагментами [16].
Ацильные производные N-арилкарбаматов в синтезе новых полифункциональных ароматических и гетероциклических соединений
Осуществлен синтез 1,2,3-тиа(селена)диазолов, тиазола, 1,3,4-тиа(окса)диазола с фенилкарбаматным фрагментом на основе метил-N-(4-ацетилфенил)карбамата [17].
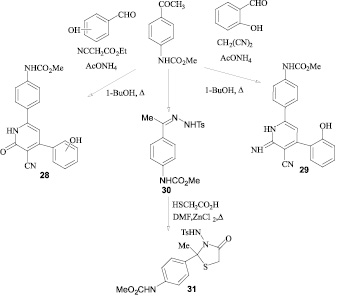
Конденсацией метил-N-(4-ацетилфенил)карбамата с салициловым альдегидом и малононитрилом (или этилцианоацетатом) в присутствии ацетата аммония получены производные пиридина (28, 29), а реакцией тозилгидразона (30) с тиоуксусной кислотой получено производное 1,3-тиазолидона (31) [18].
Халконы в синтезе новых спиро- и полигетероциклических соединений
Халконы находят широкое применение в синтезе разнообразных гетероциклических соединений. Закономерности синтеза халконов с карбаматной функцией, а также примеры синтеза на их основе новых гетероциклических соединений показаны в работе [19].
Индолиноновые халконы, полученные конденсацией метил (4(3)-ацетилфенил)карбаматов с изатином в этаноле в присутствии диэтиламина, использовались для получения спиросоединений с разнообразными гетероциклическими фрагментами, в частности пирролидиновым [20], N-метилпирролидиновым, изохинолиновым, изоксазольным, циклопропановым и пиррольным [21]. Найдено, что спиросоединения с карбаматной функцией проявляют антимикробную и противогрибковую активность в отношении ряда микроорганизмов [22].
Конденсация метил (2-ацетилфенил)карбамата с изатином в аналогичных условиях сопровождается гетероциклизацией с образованием метилового эфира 2,4′-диоксо-1,2,3′,4′-тетрагидро-1′Н-спиро[индол-3,2′-хинолин]-1′-карбоновой кислоты (48) [23]. Кипячением в смеси толуол – абсолютный этанол метил{4(3)-[2-(2-оксо-1,2-дигидро-3Н-индол-3-илиден)ацетил]фенил}карбаматов с этил 3-аминокротонатом получены соответствующие 3-пиррол-3′-илоксиндолы с карбаматной функцией. Показано, что более эффективным способом синтеза этих соединений является использование вместо енамина смеси этилацетоацетата и безводного ацетата аммония и проведение процесса в этаноле в присутствии 20 мол. % ионных жидкостей – хлорида 1-метил-3-бутилмимидазолия и тетрафторбората 1-метил-3-октилимидазолия [24].
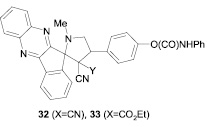
С целью получения производного индено[1,2-b]хиноксалина, спиросочленного с пиррольным кольцом, изучена пятикомпонентная реакция 1,2,3-индантриона, о-фенилендиамина, N-метилглицина, малононитрила (или этилцианоацетата) и 4-формилпроизводного фенил N-фенилкарбамата в присутствии ионной жидкости в этаноле при кипячении. Установлено [25], что реакция протекает региоспецифично с образованием спиросоединений (32, 33).
Синтез новых гетарилкарбаматов за счет олефинового и ацетиленового фрагмента карбаматной группировки
Важным реакционным центром N-замещенных ароматических карбаматов является алкоксильная часть карбаматной группировки с алкенильным и алкинильным фрагментами, обеспечивающими возможность протекания реакций 1,3-диполярного циклоприсоединения. One-pot реакцией N-оксидов бензонитрила, генерированных из оксимов соответствующих альдегидов, с карбаматами с олефиновым и алкинильным фрагментами, получены 3,5-дизамещенные изоксазолины и изоксазолы [2], а циклоприсоединением к аллил-N-фенилкарбамату нитрилиминов, генерированных из фенилгидразонов аренкарбальдегидов, получены соответствующие 3,5-дизамещенных производные пиразолина [26]. Среди синтезированных соединений найдены вещества с высокой антимикробной и противогрибковой активностью [27, 28].
Циклоприсоединение арилдиазометанов, полученных из натриевых солей тозилгадразонов бензальдегида, 4-метокси-, 2,4-диметокси- и 4-нитро- бензальдегидов по терминальной тройной связи пропаргил-N-фенилкарбамата протекает региоселективно с образованием 3,5-дизамещенных пиразолов [29].
Изучены закономерности реакций [3 + 2]-циклорисоединения к аллил-N-фенилкарбамату нитронов, включая нитроны бенздиазепинового ряда [30], а также к пропаргил-N-фенилкарбамату азометинилида, генерированных из саркозина и аценафтехинона. Изучено катализируемое L-пролином 1,3-диполярное циклоприсоединение к метил N-4-[2-(2-оксо-1,2-дигидро-3Н-индол-3-илиден)ацетил]фенил}карбамату некоторых азометинов [31].
N,N′-диалкоксикарбонилпроизводные бензохинондииминов в синтезе новых функционально замещенных арил- и гетарилкарбаматов
Химия N,N′-диалкоксикарбонилпроизводных бензохинондииминов в отличие от соответствующих ароил- и сульфонильных производных изучена в недостаточной степени. Учитывая перспективность использования N-алкоксикарбонилпроизводных бензохинондиимина в качестве полупродуктов в реакциях синтеза азагетероциклов, авторами работы [32] был разработан метод синтеза метоксикарбонилпроизводных пара- и орто-бензохинондиимина посредством окисления соответствующих аренкарбаматов тетраацетатом свинца в инертных органических растворителях.
Взаимодействие N,N′-диметоксикарбонил-п-бензохинондиимина с β-дикетонами, b-кетоэфирами, диэтилмалонатом, b-тозилзамещенными кетонами в диоксане в присутствии метоксида натрия приводит к получению аддуктов 1,4-присоединения по Михаэлю ароматической структуры [32]. Реакция N,N′-диметоксикарбонил-п-бензохинондиимина с алкилиденмалонатами в аналогичных условиях вместо ожидаемых аддуктов 1,4-присоединения по Михаэлю приводит к получению соответствующих замещенных в ядре N,N′-диметоксикарбонил-п-бензохинондииминов [33]. Закономерности индольных циклизаций аддуктов 1,4-присоединения по Михаэлю выявлены в работах [34, 35]. Поведение N,N′-диметоксикарбонил-п-бензохинондиимина в реакции Неницеску описано в работах [1, 35]. Разработаны способы модификации карбаматных производных индола, приводящие к получению в положении 3 1,3,4-тиадиазольного, гидразоно-1,3-тиазольного и 1,2,3-селена(тиа)диазольного фрагментов [35].
Изучено поведение N,N′-диметоксикарбонил-п(о)-бензохинондииминов в реакции Дильса - Альдера. Установлено [36], что взаимодействие N,N′-диметоксикарбонил-о-бензохинондиимина в хлороформе in situ с циклопентадиеном-1,3, циклогексеном и стиролом при 20 °С протекает как реакция Дильса-Альдера с обращенным электронным механизмом и приводит к получению соответствующих тетрагидрохинонксалиновых производных.
Описаны реакции N,N′-диметоксикарбонилбензохинондииминов с различными 1,3-диполярными соединениями, приводящие к получению производных индазола, 2Н-бензимидазола и бицикло[4.1.0]гепт-3-ена [2].
Установлено, что взаимодействие N,N′-диметоксикарбонил-п-бензохинондиимина и 2-хлор-N,N′-диметоксикарбонил-n-бензохинондиимина с тиоуксусной кислотой в метиленхлориде при комнатной температуре протекает как реакция 1,4-присоединения по системе сопряженных связей N=C-C=C хинондиимина с образованием продуктов ароматической структуры, кипячение которых в этаноле в присутствии концентрированной соляной кислоты в течение 5 ч сопровождается гетероциклизацией и образованием метил-N-(4-R-2-оксо-2,3-дигидро-1,3-бензотиазол-6-ил)карбаматов [37, 40]. 1,3-Бензтиазол-2(3Н)-он получен кипячением диметил 2,2′-дисульфандиилбис(2,1-фенилен)дикарбамата с цинковой пылью в ледяной уксусной кислоте [41], на основе которого были получены новые его функциональные производные.
Заключение
Приведенные в обзоре данные показывают современные достижения и основные направления изучения функционально замещенных ароматических и гетероциклических карбаматов в качестве потенциальных пролекарств с широким спектром фармакологической активности.



