Электрохимические методы анализа широко используются для определения качественного и количественного состава раствора. Среди электрохимических методов широко распространенным является потенциометрический метод, основанный на использовании электрохимических сенсоров – ионоселективных электродов (ИСЭ), обратимых к большому числу катионов и анионов. ИСЭ применяются в науке, прежде всего в аналитической химии, биологии, почвоведении, медицине, геологии, а также в технологии, в частности для автоматического контроля производственных процессов, анализа природных и сточных вод, жесткости воды. В связи с большим практическим значением ионоселективных электродов актуален вопрос о совершенствовании их конструкций.
Наиболее перспективными в этом плане являются электроды без внутреннего жидкостного заполнения – твердоконтактные электроды (ТКЭ). Такие электрохимические сенсоры на практике имеют свои преимущества и недостатки. Главное преимущество – простота использования и транспортировки. Это связано с отсутствием внутреннего раствора, в результате чего отпадает необходимость в его периодической замене, как это необходимо для электродов с внутренним жидкостным заполнением. Благодаря своей конструкции ТКЭ можно использовать практически в любом пространственном положении, что делает их незаменимыми в полевых условиях. Однако твердоконтактные электроды имеют существенный недостаток – нестабильность электродного потенциала во времени, в связи с чем возникает необходимость в проведении калибровки таких электродов перед каждым измерением.
Первые твердоконтактные электроды были разработаны еще в 1972–1974 годах в работах Катралла и Фрейзера [7]. Такими электродами были проволочные электроды с покрытием, в которых осуществлялся непосредственный контакт пленочной мембраны с электронным проводником. Электродный потенциал таких твердоконтактных сенсоров сильно и хаотично менялся во времени. В работах О.К. Стефановой [1; 4] для стабилизации потенциала на границе мембрана/токоотвод было предложено использовать полимерную окислительно-восстановительную систему, которая вводилась непосредственно во внутренний слой мембраны, контактирующей с электронным проводником. Стабильность потенциалов таких ТКЭ намного выше, чем у проволочных электродов с мембранным покрытием. Однако полученные твердоконтактные электроды имели существенный недостаток, который заключался в чувствительности ТКЭ к величине окислительно-восстановительного потенциала анализируемого раствора, что связано с диффузией растворимых окислительно-восстановительных пар из промежуточного слоя к внешней границе мембраны.
В последние десятилетия для стабилизации потенциала твердоконтактных электрохимических сенсоров вместо окислительно-восстановительных смол применяются растворимые электронопроводящие полимеры (ЭП) [5; 8; 9]. Такие полимеры вводят в состав слоя, промежуточного между мембраной и токоотводом. Электронная проводимость электронопроводящих полимеров обусловлена подвижностью делокализованных π-электронов в сопряженной структуре полимера. В работах [2; 3; 9] успешно применялся электронопроводящий полимер полианилин для стабилизации потенциала твердоконтактных электродов, селективных к ряду ионов. Было показано, что селективность таких электрохимических сенсоров практически не уступает электродам с внутренним жидкостным заполнением.
В данной работе исследовалась возможность использования другого электронопроводящего полимера, а именно поли(3-октилтиофена) (РОТ), в роли ионоэлектронного трансдьюсера для стабилизации потенциала твердоконтактного электрода. В качестве такого ТКЭ был изучен литийселективный твердоконтактный электрод.
Поли(3-октилтиофен) имеет следующую структуру:
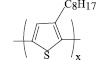
Недопированный РОТ растворим в большинстве органических растворителей. В недопированной форме РОТ является полупроводником р-типа и дает неселективный катионный отклик к ионам некоторых щелочных и щелочноземельных металлов [6].
Материалы и методы исследования
В данной работе растворы поли(3-октилтиофена) в тетрагидрофуране (ТГФ) получали непосредственно путем растворения 0,015 г РОТ в 2 мл свежеперегнанного ТГФ.
Литийселективная мембранная композиция имела следующий состав: литийселективный ионофор 1,3,5-трис[(N,N-дициклогексилкарбамил)-метокси]циклогексан в концентрации 5⋅10−3 моль·кг–1, обменник тетрапарахлорфенилборат калия в концентрации 5⋅10−3 моль·кг–1 (соотношение литийселективного ионофора и обменника было 1:1), жидкий пластификатор – бис(1-бутилпентил)адипинат. Матрицей мембраны служил поливинилхлорид (ПВХ). Данные компоненты мембраны были растворены в ТГФ. Для получения композиции переходного (внутреннего) слоя полимер поли(3-октилтиофен) добавляли в количестве 1 % (мас.) по отношению к литийселективной мембранной композиции.
Литийселективный твердоконтактный электрод представлял собой следующую конструкцию. На графитовый стержень (электронный проводник) наносили подложку из электронопроводящего композита (ЭК) состава: ПВХ : технический углерод (сажа) : пластификатор в соотношении 1:1:0,5. Далее последовательно наносили литийселективную двухслойную мембрану. Внутренний слой, контактирующий с подложкой, получали нанесением 200 мкл композиции переходного слоя. Внешний слой, непосредственно контактирующий с водным раствором, представлял собой мембранную композицию без поли(3-октилтиофена), нанесенную аналогичным образом поверх переходного слоя после его высыхания. Толщины внутреннего и внешнего слоев были одинаковы и составляли около 200 мкм. Изготовленные таким образом твердоконтактные электроды замачивали и хранили в растворе LiCl концентрации 0,01 моль·кг–1.
Изучение электродных свойств литийселективных электродов заключалось в измерении электродвижущей силы (ЭДС) гальванических элементов с переносом, построенных по схемам:
|
Ag |
AgCl, KClнас |
раствор переменного cостава: LiCl, MeClZ |
мембрана |
LiCl (0,01m), AgCl |
Ag |
(I) |
|
Электрод с жидкостным заполнением |
||||||
|
Ag |
AgCl, KClнас |
раствор переменного cостава: LiCl, MeClZ |
мембрана |
Мембрана +РОТ |
ЭК |
Cu |
(II) |
|
Твердоконтактный электрод |
|||||||
Электродные свойства электрохимических сенсоров определялись через различные промежутки времени: практически сразу после замачивания (3 часа), через сутки, 7 суток и далее с интервалом от 7 до 91 суток (время наблюдения).
Результаты исследования и их обсуждение
Важнейшими характеристиками твердоконтактных электрохимических сенсоров являются стабильность электродного потенциала во времени, катион-анионная и катион-катионная селективности. Эти характеристики были изучены в данной работе.
Прежде всего, в работе была исследована стабильность потенциалов Li-твердоконтактных электродов во времени. Исследования проводили в растворах LiCl концентрации 0,01 моль·кг–1 в течение 3 месяцев. Полученные результаты показали, что в течение первых 14 суток наблюдалось резкое падение электродного потенциала – 6–8 мВ в сутки. После этого срока потенциал относительно стабилизировался – дрейф потенциала составил 1–2 мВ в сутки в течение всего времени наблюдения (3 месяца). Аналогичные результаты были получены в работе [2; 3] для твердоконтактных электродов на основе другого электронопроводящего полимера – полианилина.
Кроме того, в работе была исследована катион-анионная селективность (литиевая функция) Li-твердоконтактных электродов в чистых растворах LiCl. Катион-анионная селективность измерялась через различные промежутки времени: начиная с 3 часов после замачивания и заканчивая 91 сутками. Для получения сравнительных результатов проводились измерения для Li-ИСЭ с внутренним жидкостным заполнением. Время установления стационарного значения потенциала ТКЭ в течение всего времени наблюдения составило 1–3 минуты, что практически не отличалось от соответствующих электродов с внутренним жидкостным заполнением. Установлено, что Li+функция выполнялась в диапазоне концентраций 1⋅101–5⋅105 моль·кг–1 c угловым коэффициентом: 58 ± 1 мВ·(pLi)–1. Аналогичные результаты получены для электродов с внутренним жидкостным заполнением. Следует отметить, что полученная катион-анионная селективность Li-ТКЭ на основе поли(3-октилтиофена) сохранялась в течение всего времени наблюдения (3 месяца).
Помимо катион-анионной селективности в работе была изучена катион-катионная селективность Li-ТКЭ в присутствии мешающих катионов-конкурентов через различные промежутки времени. Исследование проводили методом биионных потенциалов (БИП). Полученные результаты по коэффициентам селективности (lg KLi/M) для литийселективных твердоконтактных электродов представлены в таблице. Там же для получения сравнительных результатов приведены коэффициенты селективности электродов с внутренним жидкостным заполнением.
Из таблицы видно, что в первое время (14 суток) твердоконтактные электроды по своей селективности к ионам лития в присутствии ионов натрия, аммония, кальция и магния практически не отличались от электродов с внутренним жидкостным заполнением. По влиянию на селективность электродов к ионам лития ионы можно расположить в ряд, который для электродов с внутренним жидкостным заполнением можно представить следующим образом:
Na+ > H+ > Ca 2+ > Mg 2+ > NH 4+ > K+
Ряд селективности твердоконтактных электродов, полученный через сутки, определяется полученной закономерностью:
Na+ > H+ > Ca 2+ > Mg 2+ > K+ > NH4+
Из представленных зависимостей следует, что ТКЭ, как и электроды с внутренним жидкостным заполнением, проявляли наибольшую селективность к ионам лития в присутствии ионов аммония и калия, наименьшую – в присутствии ионов водорода и натрия. Единственное различие между двумя рядами селективности состоит в том, что у электродов с внутренним жидкостным заполнением селективность к ионам лития в присутствии ионов калия выше, чем в присутствии ионов аммония, а у ТКЭ – наоборот.
Селективность (lg KLi/M) Li+-ТКЭ
|
Время |
lg KLi/M |
|||||
|
Na+ |
K+ |
NH4+ |
H+ |
Ca 2+ |
Mg 2+ |
|
|
Электрод с внутренним жидкостным заполнением |
||||||
|
–1,74 |
–3,51 |
–3,34 |
–2,33 |
–2,48 |
–3,02 |
|
|
Твердоконтактный электрод |
||||||
|
3 часа |
–1,69 |
–3,37 |
–3,45 |
–1,85 |
–2,42 |
–2,97 |
|
1 сутки |
–1,72 |
–3,41 |
–3,52 |
–1,84 |
–2,46 |
–3,02 |
|
7 суток |
–1,68 |
–3,38 |
–3,51 |
–1,78 |
–2,43 |
–3,01 |
|
14 суток |
–1,66 |
–3,36 |
–3,48 |
–1,71 |
–2,42 |
–3,01 |
|
21 суток |
–1,63 |
–3,33 |
–3,45 |
–1,64 |
–2,40 |
–2,98 |
|
35 суток |
–1,58 |
–3,27 |
–3,41 |
–1,55 |
–2,37 |
–2,96 |
|
49 суток |
–1,54 |
–3,23 |
–3,36 |
–1,43 |
–2,34 |
–2.93 |
|
63суток |
–1,50 |
–3,19 |
–3,32 |
–1,32 |
–2,31 |
–2,89 |
|
77 суток |
–1,46 |
–3.14 |
–3,28 |
–1,21 |
–2,27 |
–2,85 |
|
91 суток |
–1,42 |
–3,09 |
–3,24 |
–1,11 |
–2,23 |
–2,82 |
Однако, как показал эксперимент, с течением времени селективность твердоконтактных электродов к ионам лития уменьшалась (см. таблицу). Можно предполагать, что такое снижение селективности обусловлено диффузией электродноактивных компонентов, а именно ионофора 1,3,5-трис[(N,N-дициклогексилкарбамил)-метокси]циклогексана, из внешнего слоя в подложку, которая содержит пластификатор. Таким образом, концентрация ионофора в мембране постепенно уменьшалась, что и вызывало падение селективности. Кроме того, с течением времени менялась последовательность влияния мешающих ионов-конкурентов на селективность ТКЭ к ионам лития. Через 35 суток и до конца эксперимента (91 сутки) ряд селективности твердоконтактных электродов к ионам лития представлял собой следующую зависимость:
H+ > Na+ > Ca 2+ > Mg 2+ > K+ > NH4+
Из данного ряда следует, что наибольшее влияние на селективность ТКЭ к ионам лития оказывали ионы водорода. Кроме того, как следует из данных, приведенных в таблице, именно в системе литий-водород наблюдается наиболее сильное падение селективности. Подобное влияние катионов водорода на селективность ТКЭ на основе другого электронопроводящего полимера полианилина было получено в работе [3]. Можно предположить, что это обусловлено рН-чувствительностью электронопроводящего полимера поли(3-октилтиофена), входящего в состав внутреннего слоя мембраны. С течением времени поли(3-октилтиофен) может диффундировать из внутреннего слоя мембраны во внешний, контактирующий непосредственно с анализируемым раствором, и проявлять неселективный отклик на ионы водорода, что и вызывает падение селективности электродов к ионам лития.
Выводы
1. Предложенные литийселективные твердоконтактные электрохимические сенсоры проявляют литиевую функцию в диапазоне концентраций 1⋅101–5⋅105 моль·кг–1 с угловым коэффициентом 57 ± 2 мВ·(pLi)1, что не отличается от соответствующих электродов с внутренним жидкостным заполнением. Литиевая функция сохраняется в течение всего времени наблюдения (3 месяца).
2. Селективность твердоконтактных электродов к ионам лития в присутствии мешающих катионов-конкурентов в течение первых 10 дней практически не отличается от электродов с внутренним заполнением, однако в дальнейшем постепенно снижается.
3. Дрейф потенциала Li-твердоконтактных электродов составляет 68 мВ·сут1 в течение первых 14 суток и 12 мВ·сут1 в последующее время. Электроды пригодны для непрерывных измерений в течение 10 часов без промежуточных калибровок.
4. Электронопроводящий полимер поли(3-октилтиофен) можно с успехом применять для стабилизации потенциала твердоконтактных электрохимических сенсоров.



