Производные гликозилизотиоцианатов являются ключевыми соединениями в синтезе разнообразных углеводных производных тиокарбамидов [4, 6]. Они служат ценными синтонами в тонком органическом синтезе, особенно в области химии гетероциклов и гликозилтиокарбамидов. Продолжая поиск новых биологически активных соединений в ряду углеводных производных тиокарбамидов, авторами изучили реакции изотиоцианатов с аминосодержащими гетероциклическими соединениями, обладающими широким спектром биологического действия [1, 2, 4, 5]. Введение в структуру гетероциклических соединений углеводов с гликозилтиоамидными связями является одним из перспективных путей получения новых биологически активных соединений. Ранее было показано, что конденсация гликозилизотиоцианата с производными адамантана приводит к образованию углеводных производных адамантилтиомочевин, обладающих широким спектром физиологического действия [1, 5].
Принципы построения гетероциклических систем и методические приемы в работе с углеводными аналогами изотиоцианатных фрагментов достаточно хорошо известны и не требуют особых пояснений. Следующие достаточно очевидные примеры формирования структур могут служить примерами гетероциклизации (рис. 1).
Целью настоящей работы является разработка препаративных методов синтеза мало известного углеводного производного морфолина путем взаимодействия 1 – изотиоциано –1–дезокси –2,3,4,6–тетра – 0 –ацетил – β – D – гликопираноз с морфолином в среде абсолютного ацетонитрила и проведение компьютерного прогноза биологической активности синтезированных соединений. Синтез углеводных производных тиомочевин на основе морфолина был осуществлен согласно приведенной схеме (рис. 2).
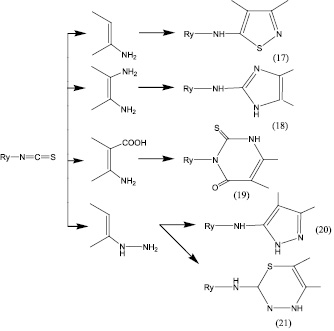
Рис. 1. Здесь Rу – углевод
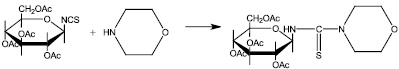
Рис. 2
Материалы и методы исследования
ПМР спектр углеводного производного морфолина был снят на приборе: «Bruker WM-250» с рабочей частотой 250 мГц. ИК-спектр получен на спектрофотометре ИКС-29, Specord M-80 с программой «Soft Spectra». Температура плавления измерялась на микронагревательном столике «Baetuis». Контроль за ходом реакций и индивидуальностью веществ осуществляли методом ТСХ на пластинах Silufol UV-254. Пятна проявляли парами йода во влажной камере. Температуры плавления определяли на приборе ПТП-М.
Результаты исследования и их обсуждение
Были изучены реакции взаимодействия D-глюкозил-, D-галактозил-, D-ксилозил-изотиоцианатов с морфолином. Реакции взаимодействия гликозилизотиоцианатов с морфолином в среде абсолютного ацетонитрила приводят к образованию N-гликопиранозил–N1–морфилтиомочевин. В условиях проведения реакций не наблюдается образования побочных продуктов. Реакция привела к образованию белого кристаллического продукта с выходом 70–80 %. Контроль за ходом реакции осуществляли методом тонкослойной хроматографии в системе: хлороформ : ацетонитрил (5:1), хлороформ : метанол (10:1). В подобных условиях были получены конечные продукты, физико-химические характеристики которых представлены в табл. 1.
Таблица 1
Физико-химические характеристики N-гликопиранозил-N1-морфилтиомочевин
|
Вещество Брутто формула |
Выход, % |
Тпл, °С |
Rf |
Найдено (вычислено), % |
||
|
С |
N |
Н |
||||
|
№ 1 С19H28N2O10S (глюкоза) |
74 |
129–130 |
0,20 |
47,52 (47,89) |
5,45 (5,92) |
6,18 (5,88) |
|
№ 2 С19H28N2O10S ( галактоза) |
73 |
123–124 |
0,25 |
47,44 (47,89) |
5,89 (5,92) |
6,01 (5,88) |
|
№ 3 С16H23N2O 8S (ксилоза) |
83 |
118–119 |
0,34 |
47,30 (47,64) |
5,56 (5,7) |
6,83 (6,94) |
Примечание. Здесь № 1 N-(2,3,4,6-тетра-0-ацетил-β-D-глюкопиранозилтиокарбамоил)-N1-морфолин, № 2 N-(2,3,4,6-тетра-0-ацетил-β-D – галактопиранозилтиокарбамоил)-N1-морфолин, № 3 N-(2,3,4,-три-0-ацетил-β D-ксилопиранозилтиокарбамоил)-N1-морфолин.
Структура синтезированных N-(2,3,4,6-тетра-0-ацетил-β D-гликопиранозилтиокарбамоил)N1-морфолинов подтверждена данными ИК, Н1ЯМР-спектроскопии и данными элементного анализа.
В последние годы при прогнозировании свойств физиологически активных веществ широко применяются математические методы установления связи «биологическая активность – химическая реакционная способность – структура». Поэтому актуальным представляется поиск путей целенаправленной химической модификации молекулярной структуры известных лекарственных препаратов и новых физиологически активных соединений, обладающих ценными фармакологическими свойствами при помощи N-гликозил (тио)амидной связи.
Программы PASS [3] позволяют на основании структуры соединения количественно оценить вероятность наличия у него активности (Ра) и неактивности (Рi) различных видов биологической активности. С помощью данной программы мы оценили активность соединений, известных как производные тиокарбамидов сахаров на основе морфолина. Чем больше для конкретной активности величина Pa и чем меньше величина Pi, тем больше шанс обнаружить данную активность у вещества, полученного в эксперименте. Как видно из табл. 2, величина Ра/Рi с большой вероятностью указывает на наличие противоопухолевой активности.
Таблица 2
Компьютерный прогноз биологической активности синтезированных соединений
|
Вид биологической активности |
№ 1 Ра/Рi глюкоза |
№ 2 Ра/Рi галактоза |
№ 3 Ра/Рi ксилоза |
№ 4 Ра/Рi глюкоза |
№ 5 Ра/Рi галактоза |
№ 6 Ра/Рi ксилоза |
|
Противоопухолевая активность |
0,910 0,005 |
0,910 0,005 |
0,755 0,003 |
0,388 0,111 |
0,388 0,111 |
0,474 0,049 |
|
Стимуляторы светотерапии |
0,753 0,003 |
0,753 0,003 |
0,755 0,003 |
|||
|
Ингибитор проницаемости мембран |
0,769 0,016 |
0,769 0,016 |
0,751 0,021 |
|||
|
Ингибитор β-глюкоуронидазы |
0,787 0,002 |
0,787 0,002 |
0,711 0,004 |
0,743 0,003 |
0,743 0,003 |
0,773 0,004 |
|
Профилактика стеноза |
0,918 0,002 |
0,918 0,002 |
0,614 0,004 |
0,371 0,009 |
0,371 0,009 |
0,365 0,010 |
|
Антигельминтные свойства |
0,403 0,041 |
0,403 0,041 |
0,443 0,029 |
|||
|
Антипаразитарные свойства |
0,335 0,046 |
0,335 0,046 |
0,378 0,036 |
|||
|
Антибактериальные свойства |
0,380 0,035 |
0,380 0,035 |
0,354 0,042 |
0,414 0,036 |
0,414 0,036 |
0,398 0,040 |
|
Антивирусные свойства |
0,336 0,068 |
0,336 0,068 |
0,354 0,058 |
0,671 0,008 |
0,671 0,008 |
0,661 0,008 |
|
Антиоксидант |
0,324 0,019 |
0,324 0,019 |
0,513 0,003 |
0,513 0,003 |
0,494 0,003 |
|
|
Ингибитор бактерицидной активности |
0,797 0,001 |
0,797 0,001 |
0,805 0,001 |
Примечание. Здесь № 1 N-(2,3,4,6-тетра-0-ацетил-β-D-глюкопиранозилтиокарбамоил) -N1-морфолин, № 2 N-(2,3,4,6-тетра-0-ацетил-β-D-галактопиранозилтиокарбамоил) -N1-морфолин, № 3 N-(2,3,4,-три-0-ацетил-β D-ксилопиранозилтиокарбамоил) -N1-морфолин, № 4 – амин 3,6-диазагомоадамантана с глюкозой, № 5 -амин 3,6-диазагомоадамантана с галактозой, № 6 – амин 3,6-диазагомоадамантана с ксилозой.
Эти вероятности рассчитываются независимо, по подвыборкам активных и неактивных соединений, и поэтому их сумма не равна единице. Прогноз осуществляется по структурной формуле химического соединения и основан на анализе базы знаний, включающей данные о взаимосвязи «химическая структура – активность». Расчеты компьютерного прогноза в виде диаграмм для углеводных производных на основе морфолина и на основе диазаполицикланов представлены на рис. 3 и 4. Так, для глюкопиранозилтиокарбамида отмечается высокий показатель 5-го вида активности (профилактика стеноза), тогда как для амина 3,6-дизагомоадаматана (производного, также на глюкозе) наблюдается другой вид активности (антигемморагические свойства). Для более точного сравнения виды биологической активности были приняты одни и те же.
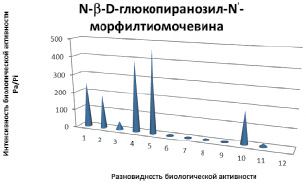
Рис. 3. Компьютерный прогноз биологической активности N-(2,3,4,6-тетра-0-ацетил-β-D-глюкопиранозилтиокарбамоил) -N1-морфолин: 1 – стимулятор светотерапии; 2 – противоопухолевая активность; 3 – ингибитор мембр. проницаемости; 4 – ингибитор β-глюкоуронидазы; 5 – профилактика стеноза; 6 – антигельминтные свойства; 7 – антипаразитарные свойства; 8 – антибактерицидные свойства; 9 – противовирусные свойства; 10 – антиоксидатные свойства; 11 – антигемморагические свойства
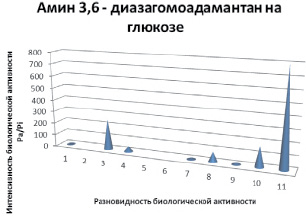
Рис. 4. Компьютерный прогноз биологической активности амина 3,6-диазагомо-адамантана на глюкозе
Заключение
1. Синтезированы ранее неизвестные морфолинсодержащие вещества:
1) N-(2,3,4,6-тетра-0-ацетил-β-D-глюкопиранозилтиокарбамоил) -N1-морфолин;
2) N-(2,3,4,6-тетра-0-ацетил-β-D-галактопиранозилтиокарбамоил) -N1-морфолин;
3) N-(2,3,4,-три-0-ацетил-β D-ксилопиранозилтиокарбамоил) -N1-морфолин.
2. Установлена структура полученных веществ, индивидуальность новых соединений доказана использованием совокупности современных физических и химических методов исследования: ИК- и Н1ЯМР-спектроскопией, методом элементного анализа и методом тонкослойной хроматографии.
3. Программы PASS показывают замечательную прогностическую способность. С введением углеводной компоненты такие виды активности, как противоопухолевая, антивирусная, антигельминтная, антибактерицидная, увеличиваются при общем снижении токсичности. Данные виды активности с введением моносахаридов повышаются в ряду: галактоза = глюкоза > ксилоза.



