Органические примеси питьевых вод могут способствовать развитию йододефицитных состояний [9], стабилизации степени окисления железа (Ш) с последующим действием на процессы кроветворения [7].
Соединения меди (II) в водных системах биологических объектов находятся в форме смешанных комплексов с молекулами аминокислот, пептидов, входят в состав ферментов. Например, медьсодержащий белок плазмы крови – церулоплазмин [ЦПСu2+] катализирует окисление Fe2+ в Fe3+ и участвует в процессах кроветворения [2]:
Fe 2+ + [ЦПCu 2+ ] → Fe 3+ + [ЦПCu+]. (1)
Очевидно, что в медьсодержащих ферментах стабилизация меди (II) приведет к снижению процесса синтеза гемоглобина. На свойства меди (II) в биологических комплексах могут оказывать влияние органические соединения, присутствующие в питьевых водах [8]. Это обусловлено наличием в структуре природных органических примесей питьевых вод эфирных, фенольных, карбоксильных и хиноидных групп, которые способны к комплексообразованию с ионами меди (II) и образованию сложных полилигандных комплексов [5]. В качестве эталона сравнения комплексообразующих свойств природных органических примесей в работе [6] предложено использовать салициловую кислоту.
В качестве модельных растворов были использованы растворы салициловой кислоты (Sal) (образцы № 4 и 9 с содержанием общего органического углерода (ООУ) 10 и 100 мг/л соответственно), лимонной кислоты (Сitr) (образцы № 2 и 7 с содержанием ООУ 10 и 100 мг/л), глутаминовой (Глу) (образцы № 3 и 8 с содержанием ООУ 10 и 100 мг/л). Концентрация ионов меди (II) в растворах сравнения и модельных растворах с органическими веществами составляла 3 или 30 мг/л.
Кроме того, были исследованы образцы воды водопроводной города Екатеринбурга с содержанием общего органического углерода (ООУ) 5,5 мг/л и фильтрованная водопроводная вода с содержанием ООУ – 4,4 мг/л.
Для оценки комплексообразующей способности меди (II) в различных водных системах был использован метод электронного парамагнитного резонанса (ЭПР). Применения метода ЭПР в биологии и медицине разнообразны [3, 9], и одним из перспективных направлений его использования считается оценка состояния меди в биологических комплексах [1].
Спектры ЭПР (первая производная спектра поглощения) замороженных образцов растворов (объем 100 мкл) измерялись при 170 К на спектрометре трехсантиметрового диапазона EMX Plus фирмы Bruker (Германия) (микроволновая мощность 6 мВт, магнитная модуляция 0,5 мТ).
Дополнительно для оценки комплексообразующей способности меди (II) с органическими примесями водных систем использовали метод, разработанный авторами [8], сущность которого отражает следующая реакция:
2[СuL4] 2– + 4I– → 2CuI + I2 + 8L–, (2)
где L – органический лиганд. Концентрация йода определялась с помощью построенной градуировочной зависимости между содержанием йода в системе и величиной оптической плотности, измеренной при длине волны 285 нм на УФ-спектрофотометре «Leki» (Финляндия).
Экспериментальные данные представлены на рис. 1–4. Как видно на рис. 1, при концентрациях в растворе ионов Cu 2+ 3 мг/л (кривая 2) надежно регистрировать их резонанс затруднительно как из-за малого отношения сигнал/шум, так и влияния паразитных сигналов. Поэтому все ЭПР измерения проводились при концентрации 30 мг/л (кривая 1).
Интенсивный провал на рис. 1 с резонансным положением 324 мТ обусловлен комплексами Сu 2+ с g⊥ = 2.08. Его большая интенсивность обусловлена как большим количеством комплексов с g⊥, так и суммированием сигналов от различных комплексов с близкими значениями g⊥. Низкополевая часть спектра демонстрирует сверхтонкую структуру по крайней мере трех комплексов с g|| = 2,37 (доминирует по интенсивности), g|| = 2,33, g|| = 2,4 и практически одинаковым параметром сверхтонкого взаимодействия А|| ≈ 13,5 мТ.
На рис. 2 и 3 приводятся спектры, представляющие разность спектров образца и фона, обусловленного сигналами микроволнового резонатора, криостата и ампулы. На рис. 2 представлены спектры ЭПР образцов № 1–4 (содержание Cu 2+ 30 мг/л, примесей органической природы 10 мг/л по ООУ), тогда как на рис. 3 приведены спектры ЭПР образцов № 1–4 (содержание Cu 2+ 30 мг/л, примесей органической природы 100 мг/л по ООУ).
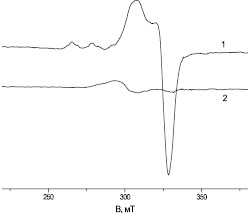
Рис. 1. ЭПР спектр (производная спектра поглощения) замороженного (170 К) раствора с ионами меди (II): 1 – концентрация меди 30 мг/л; 2 – 3 мг/л. В – индукция магнитного поля
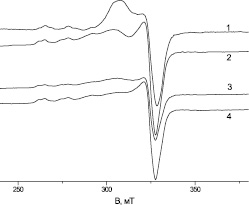
Рис. 2. ЭПР спектр замороженного (170 К) раствора с ионами Cu 2+ , концентрация меди 30 мг/л: 1 – дистиллированная вода; 2 – лимонная кислота; 3 – глутаминовая; 4 – салициловая; концентрация кислот – 10 мг/л ООУ
На рис. 2 низкополевые части спектров образцов с органическими кислотами (ООУ 10 мг/л) практически не отличаются от спектра с дистиллированной водой, что, по-видимому, связано с низкой концентрацией ООУ в растворах.
На рис. 3 в спектре наблюдается увеличение ширины линии в районе g⊥, что обусловлено изменением состава медных комплексов с увеличением их многообразия и, следовательно, разброса g⊥. Важно отметить, что при одинаковой концентрации органических соединений (100 мг/л) более устойчивые комплексные ионы с салициловой кислотой имеют большую ширину (рис. 3, кривая 4), то есть большее отклонение от характеристического спектра комплекса меди (II) [6]. Кроме того, наблюдается уменьшение интенсивности компонент с g|| = 2,4 и g|| = 2,37, доминирующих в воде без органических соединений, при этом сильно растут сигналы комплексов с меньшим g||.
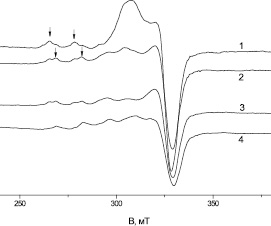
Рис. 3. ЭПР спектр замороженного (170 К) раствора с ионами Cu2+, концентрация меди 30 мг/л: 1 – дистиллированная вода; 2 – лимонная кислота; 3 – глутаминовая; 4 – салициловая; концентрация кислот – 100 мг/л ООУ
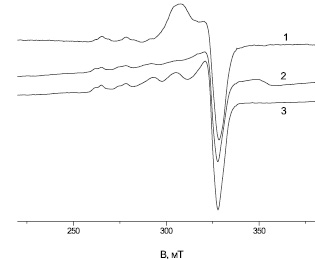
Рис. 4. ЭПР спектр замороженного (170 К) раствора с ионами меди (II), концентрация меди 30 мг/л: 1 – дистиллированная вода; 2 – водопроводная; 3 – фильтрованная
На рис. 4 представлены спектры ЭПР разных типов вод. Каждый из приготовленных растворов содержит ионы меди 30 мг/л. Анализ ЭПР спектров на рис. 4 показывает, что образец № 1 (ионы меди (II) в дистиллированной воде) содержит минимальное количество органических примесей, а интенсивность пика максимальна. В водопроводной воде (образец № 2) спектры менее выраженные в связи с ростом их многообразия, кроме того, наблюдается сигнал с g = 1,91. В фильтрованной воде (образец № 3) исчезает спектр с параметрами A|| = 14 mT, g|| = 2,33 и растет количество комплексов с g|| = 2,4.
Вода водопроводная фильтрованная (образец № 3) по составу, конечно же, отличается от воды водопроводной (образец № 2), в которой органические примеси преобладают, но их спектры в целом заметно отличаются от спектров дистиллированной воды с ионами меди. Также следует заметить, что природа органических примесей в водопроводной воде иная, чем в модельных растворах.
В таблице представлены данные, полученные авторским методом (измерение концентрации йода), которые позволяют оценить окислительные свойства соединений меди (II) при ее концентрации в растворе 3 мг/л в присутствии различных органических веществ.
Из данных, представленных в таблице, можно заключить, что процент снижения йода максимальный в системе, содержащей водопроводную воду, по сравнению с другими системами, в том числе и по сравнению с системой, содержащей салициловую кислоту.
Если принять активность единицы ООУ в составе салициловой кислоты за 2,8 %, то активность единицы ООУ в составе глутаминовой и лимонной кислот составит 0,5 %, то есть в 5 раз меньше. В водопроводной воде, наоборот, активность природных органических примесей (в пересчете на единицу ООУ) в 1,9 раза выше. Важно отметить, что снижение ООУ в фильтрованной воде всего лишь на 20 % приводит к существенному снижению активности по отношению к меди (II).
Таким образом, природные органические примеси, содержащиеся в водопроводной воде г. Екатеринбурга, имеют высокую комплексообразующую активность, которая в 1,9 раз превышает активность салициловой кислоты. За счет удаления части органических примесей из воды в процессе фильтрации существенно изменяется активность оставшихся органических примесей по отношению к меди (II).
Состав водных растворов и содержание йода после взаимодействия с йодистым калием
|
Вещество, присутствующее в системе |
ООУ, мг/л |
C [Cu 2+ ], мг/л |
C [I2], мг/л |
Процент снижения йода |
Процент снижения на единицу ООУ |
Ккоп относит. Sal |
|
Дистиллированная вода |
– |
3 |
4,55 |
– |
– |
– |
|
Модельная система Sal |
10,0 |
3 |
3,26 |
28 |
2,8 |
1,00 |
|
Модельная система Глу |
10,0 |
3 |
4,35 |
5 |
0,5 |
0,18 |
|
Модельная система Сitr |
10,0 |
3 |
4,32 |
5 |
0,5 |
0,18 |
|
Водопроводная вода |
5,5 |
3 |
3,23 |
29 |
5,27 |
1,88 |
|
Фильтрованная водопроводная вода |
4,4 |
3 |
4,34 |
5 |
1,1 |
0,40 |
Примечание. * Ккоп – коэффициент оценивания комплексообразующей активности органических примесей, Ккоп = (процент снижения/ООУ×2,8).
Выводы
1. Применяемая нами аппаратура для измерения спектров ЭПР с типовой для современной ЭПР-техники чувствительностью не позволяет контролировать комплексообразование органических примесей водных систем с медью (II) при концентрациях последней ниже 3 мг/л из-за неудовлетворительного соотношения полезного сигнала от комплекса меди и шумов аппаратуры. В то же время при концентрациях меди 30 мг/л и более техника ЭПР надежно фиксирует особенности комплексообразования органических примесей водных систем с медью (II).
2. На основании результатов, полученных спектрофотометрическим методом, можно заключить, что природные органические примеси, содержащиеся в водопроводной воде г. Екатеринбурга, имеют высокую комплексообразующую активность, которая в 1,9 раз превышает активность салициловой кислоты. Несмотря на то, что процент снижения ООУ составляет 20 %, за счет удаления части органических примесей из воды в процессе фильтрации, существенно изменяется активность оставшихся органических примесей по отношению к меди (II).



