Исследования корреляции структура – активность позволяют количественно охарактеризовать биологическую активность, на которую оказывают влияние факторы, связанные с физико-химическими свойствами, например, с константами ионизации [1, 3, 4]. Процессы ионизации веществ в значительной степени определяют особенности их всасывания и транспорта в желудочно-кишечном тракте, влияя на степень выраженности фармакологического действия [5, 6].
В работе [4] показана зависимость гипогликемической активности изучаемых соединений от констант кислотности и основности, коэффициент корреляции при этом находится в пределах (0,847–0,939) в ряду N’-ацилгидразидов N–ацил–5–бром(5–йод) антраниловых кислот. В продолжение этих исследований проведён корреляционный анализ количественной зависимости величины гипогликемической активности (ГГА) в ряду замещенных амидов N–ацил–5–бром(5–йод) антраниловых кислот (I–IX) от экспериментально определенных констант ионизации.
Гипогликемическую активность (табл. 1) изучали на самках белых нелинейных крыс массой 190–220 г. Изучаемые 9 соединений вводили через рот в скрининговой дозе 25 мг/кг. Уровень гликемии характеризовали глюкозооксидазным методом. Содержание глюкозы в крови животных определяли до, а также через 3 и 5 часов после введения исследуемых соединений [2]. Для проведения расчётов использованы уровни ГГА без учета отклонений.
Значения ГГА 3 часа и ГГА 5 часов исследованных амидов лежат в интервале от + 5,30 до –23,91 % и от + 0,70 до –21,30 % соответственно. У соединений I–VII, IX со временем происходит значительное уменьшение ГГА. Исключением является амид VII, у которого через 5 часов наблюдается снижение сахара в крови с – 19,10 до – 21,30 %.
При анализе соединений I–VI, содержащих в NH-ацильном фрагменте 4-нитро (метил)бензоильный радикал, обнаружено, что наибольшую активность проявил амид III с аллильным заместителем в амидной группе (–23,91 и –15,24 %). Замена аллильного заместителя на алкилфенильный (соед. II) приводит к значительному снижению ГГА через 3 часа (ГГА 3 ч) до –11,60 и ГГА через 5 часов (ГГА 5 ч) до –1,61 %. Дальнейшее варьирование заместителями в амидной группе (соед. I, II, V) несколько снижает ГГА 3 ч и ГГА 5 ч по сравнению с амидом III. Среди адамантиламидов VII–IX выраженную гипогликемическую активность проявило соединение VII, содержащее NH-фураноильный фрагмент.
Таблица 1
Гипогликемическая активность соединений из ряда замещенных амидов N–ацил–5–бром (5–йод) антраниловых кислот (I–IX)
|
№ п/п |
X |
R |
R1 |
Изменение гликемии, % |
|
|
ГГА 3 ч |
ГГА 5 ч |
||||
|
I |
Br |
C6H4(4–NO2) |
NHCH2CH2OH |
–19,90 ± 4,92* |
–0,40 ± 4,08 |
|
контроль |
–2,70 ± 1,97 |
–4,90 ± 3,65 |
|||
|
II |
Br |
C6H4(4–NO2) |
NHCH2C6H5 |
–11,60 ± 5,61 |
–1,61 ± 4,81 |
|
контроль |
–2,70 ± 1,97 |
–4,90 ± 3,65 |
|||
|
III |
Br |
C6H4(4–NO2) |
NHCH2CH = CH2 |
–23,91 ± 4,13* |
–15,24 ± 3,84* |
|
контроль |
–4,92 ± 2,02 |
–4,17 ± 1,13 |
|||
|
IV |
Br |
C6H4(4–NO2) |
морфолил |
–16,10 ± 10,11 |
+ 0,70 ± 5,36 |
|
контроль |
–4,92 ± 2,02 |
–4,17 ± 1,13 |
|||
|
V |
I |
C6H4(4–CH3) |
морфолил |
–19,40 ± 5,60* |
–4,20 ± 5,28 |
|
контроль |
–4,92 ± 2,02 |
–4,17 ± 1,13 |
|||
|
VI |
I |
C6H4(4–CH3) |
NHCH3 |
–12,50 ± 4,07 |
–0,90 ± 2,10 |
|
контроль |
–4,92 ± 2,02 |
–4,17 ± 1,13 |
|||
|
VII |
I |
2–фурил |
NHАдамантил |
–19,10 ± 4,18* |
–21,30 ± 4,42* |
|
контроль |
–6,50 ± 1,30 |
–4,40 ± 2,00 |
|||
|
VIII |
I |
C6H4(4–CH3) |
CH2C6H5 |
–12,00 ± 6,16 |
–5,30 ± 5,02 |
|
контроль |
–3,50 ± 2,30 |
–6,40 ± 2,10 |
|||
|
IX |
I |
C6H5 |
NHАдамантил |
+ 5,30 ± 16,80 |
+ 2,60 ± 10,30 |
|
контроль |
–6,50 ± 1,30 |
–4,40 ± 2,00 |
|||
|
Метформин |
+ 4,30 ± 4,10 |
+ 5,30 ± 2,80 |
|||
|
Карбутамид |
–21,20 ± 2,0* |
–21,90 ± 2,80** |
|||
Примечание. Достоверность отличий по сравнению с контролем при р ≤ 0,05 – *, р ≤ 0,01 – **.
Амид VIII c заместителем бензиламин в амидной группе проявил слабую активность ГГА 3 ч – 12,00 %, ГГА 5 ч – 5,30 %.
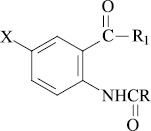
Замещённые амиды N–ацил–5–бром(5–йод) антраниловых кислот (I–IX) содержат две азотсодержащие ионогенные группы: амидная и NH–ацильная, в зависимости от условий среды они проявляют как кислотные, так и основные свойства и характеризуются константами кислотности (pKa) и основности (pKв).
Для изучения количественной зависимости гипогликемической активности от физико-химических свойств соединений (I–IX) экспериментально определены константы кислотности (рКаэксп) и основности (рКвэксп) методом потенциометрического титрования в среде диметилсульфоксида (ДМСО) с помощью универсального иономера ЭВ–74 по методу потенциалов полунейтрализации [1, 4] (табл. 2). Концентрация определяемых соединений 0,005 М, концентрация титрантов – KOH и HClO4 – 0,05 М.
Схемы ионизации молекул замещённых амидов N–ацил–5–бром(5–йод) антраниловых кислот (I–IX) в щелочной и кислой средах составлены с учётом величины зарядов на атомах азота, кислорода и водорода (в электронных единицах). Заряды (табл. 2) были рассчитаны неэмпирическим методом Хартри – Фока в базисе 3-21G с полной оптимизацией геометрии молекул в среде ДМСО, с использованием программы Gaussian 03. Эффект растворителя учитывали проводя расчёты на модели PCM (Polarizable Continuum Model).
В результате проведенных квантово-химических расчётов обнаружено, что наибольший отрицательный заряд на атоме азота в NH–ацильной группе (от –1,021 до –1,064). Зависимости в виде коэффициента корреляции, констант кислотности RpKa и основности RpKв, от зарядов на атомах азота приведены в табл. 2. Наибольшие значения коэффициента корреляции найдены на атоме кислорода в NH–ацильной группе (RpKa = 0,476, RpKв = 0,510). Таким образом, можно сделать вывод об определяющем влиянии NH–ацильной группы и её заместителей на кислотные и основные свойства.
Кислотные свойства соединений (I–IX) обусловлены атомом водорода аминогруппы в NH-ацильном фрагменте, который по результатам расчёта в среде ДМСО связан с наиболее электроотрицательным атомом азота и является наиболее подвижным в сравнении атомом водорода в амидной группе. В процессе ионизации в щелочной среде (КОН) они теряют протон, превращаясь в сопряжённое основание (схема 1).
Таблица 2
Рассчитанные заряды на атомах кислорода, азота и водорода в амидной (CONH) и NH–ацильной (NHCO) группах (I–IX) и константы ионизации
|
Номер соединения |
Амидная (CONH) |
NH–ацильная (NHCO) |
рКа |
рКв |
|||
|
O |
N |
N |
H |
O |
|||
|
I |
–0,666 |
–0,909 |
–1,021 |
0,394 |
–0,651 |
10,27 |
9,66 |
|
II |
–0,654 |
–0,906 |
–1,024 |
0,399 |
–0,645 |
10,95 |
9,79 |
|
III |
–0,677 |
–0,911 |
–1,047 |
0,399 |
–0,648 |
9,20 |
8,76 |
|
IV |
–0,661 |
–0,883 |
–1,026 |
0,399 |
–0,645 |
10,40 |
9,70 |
|
V |
–0,675 |
–0,889 |
–1,054 |
0,395 |
–0,666 |
4,28 |
5,27 |
|
VI |
–0,661 |
–0,905 |
–1,026 |
0,391 |
–0,663 |
9,24 |
8,05 |
|
VII |
–0,697 |
–0,976 |
–1,051 |
0,418 |
–0,673 |
8,45 |
8,82 |
|
VIII |
–0,704 |
–0,931 |
–1,039 |
0,410 |
–0,663 |
10,39 |
8,84 |
|
IX |
–0,696 |
–0,991 |
–1,064 |
0,400 |
–0,663 |
10,84 |
9,40 |
|
RpKa |
0,044 |
0,251 |
0,400 |
0,090 |
0,476 |
||
|
RpKв |
0,072 |
0,262 |
0,400 |
0,197 |
0,510 |
||
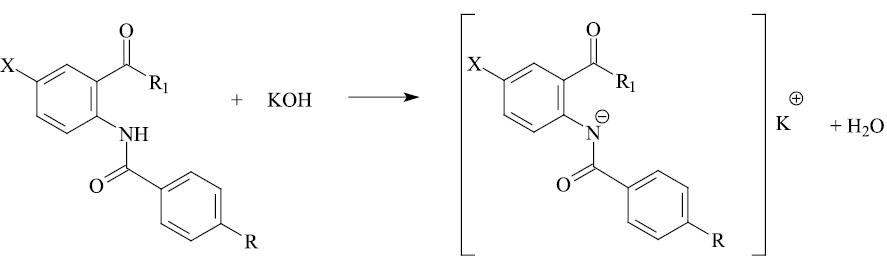
Схема 1
В кислой среде протонирование амидов (I–IX), содержащих две карбонильные группы, происходит по атому азота NH–ацильной группы, вследствие чего в кислой среде следует ожидать образование аммониевого катиона (схема 2).
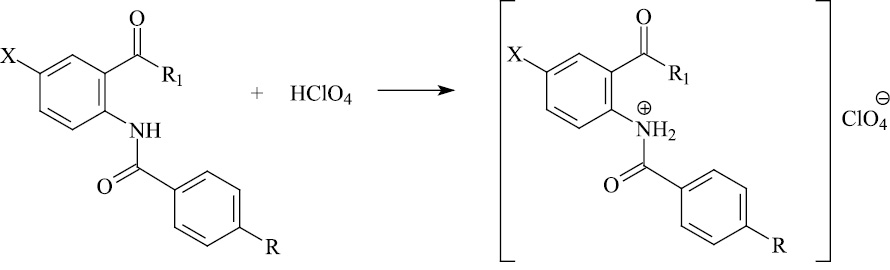
Схема 2
Соединения I–IV, содержащие в NH-ацильном фрагменте 4-нитробензоильный радикал, обладают слабыми кислотными свойствами, значения рКа от 9,20 до 10,95. Замена в 4-м положении ароильного фрагмента нитрогруппы на метильную (соед. V и VI) вызывает усиление кислотных свойств амидов (до рКа 4,28). Для соединения IX наблюдается некоторое ослабление кислотных свойств ((рКа 10,39). Основные свойства соединений I–IV выражены в большей степени, чем в соединениях V и VI.
Проведен линейный регрессионный анализ с использованием программы Statistica 6. Составлены однопараметровые уравнения зависимости ГГА от рКа и рКв (табл. 3): № 1 и 2 (ГГА 3 ч) и 9, 10 (ГГА 5 ч), коэффициент корреляции (R) при использовании констант кислотности выше (R = 0,428 и 0,289), чем констант основности (R = 0,261 и 0,123). Возведение в квадрат констант кислотности приводит к увеличению величины R для ГГА 3 ч и ГГА 5 ч и находится в интервале 0,3–0,5.
С целью увеличения качественной оценки тесноты связи мы составили два полиномиальных уравнения второй степени, содержащие рКа и рКв (уравнения (7) и (15)). В результате коэффициент множественной корреляции увеличился до 0,813 и 0,947 для ГГА 3 ч и ГГА 5 ч соответственно. Для снижения количества переменных, с использованием опции пошагового включения параметров в программе Statistica 6, мы сократили число независимых переменных c четырех до двух. Оценка тесноты связи при этом уменьшилась до 0,716 (уравнение (8)) и 0,737 (уравнение (16)).
Проведена проверка наиболее значимых уравнений (7), (8), (15), (16) на прогнозирующую способность с использованием экспериментально определенных значений констант ионизации соединений X и XI (табл. 4).
Таблица 3
Корреляционные уравнения связи значений ГГА с константами ионизации замещенных амидов N–ацил–5–бром(5–йод) антраниловых кислот (I–IX)
|
№ п/п |
Корреляционное уравнение |
R |
S |
N |
|
1 |
ГГА 3 ч = –30,737 + 1,754×рКа |
0,428 |
8,19 |
9 |
|
2 |
ГГА 3 ч = –28,087 + 1,578×рКв |
0,261 |
8,75 |
9 |
|
3 |
ГГА 3 ч = –26,086 + 0,128×рКа2 |
0,482 |
7,94 |
9 |
|
4 |
ГГА 3 ч = –22,540 + 0,105×рКв2 |
0,264 |
8,74 |
9 |
|
5 |
ГГА 3 ч = –5,331 + 7,919×рКа – 9,536×рКв |
0,644 |
7,49 |
9 |
|
6 |
ГГА 3 ч = –14,637 + 0,472×рКа2 – 0,552×рКв2 |
0,698 |
7,01 |
9 |
|
7 |
ГГА 3 ч = – 254,554 – 71,556×рКа + 128,854×рКв + 4,271×рКа2 – 7,764×рКв2 |
0,813 |
6,98 |
9 |
|
8 |
ГГА 3 ч = 17,977 – 8,926×рКв + 0,498×рКа2 |
0,716 |
6,83 |
9 |
|
9 |
ГГА 5 ч = –15,490 + 1,116×рКа |
0,289 |
8,17 |
9 |
|
10 |
ГГА 5 ч = –11,178 + 0,702×рКв |
0,123 |
8,47 |
9 |
|
11 |
ГГА 5 ч = –13,665 + 0,094×рКа2 |
0,375 |
7,91 |
9 |
|
12 |
ГГА 5 ч = –9,848 + 0,061×рКв2 |
0,164 |
8,42 |
9 |
|
13 |
ГГА 5 ч = – 9,342 + 7,141×рКа – 9,321×рКв |
0,577 |
7,53 |
9 |
|
14 |
ГГА 5 ч = –2,830 + 0,419×рКа2 – 0,522×рКв2 |
0,631 |
7,15 |
9 |
|
15 |
ГГА 5 ч = 401,996 + 66,141×рКа – 169,512×рКв – 2,981×рКа2 + 9,314×рКв2 |
0,947 |
3,62 |
9 |
|
16 |
ГГА 5 ч = 36,161 – 10,094×рКв + 0,512×рКа2 |
0,737 |
6,23 |
9 |
Таблица 4
Экспериментальные значения констант ионизации соединений (X–XI)
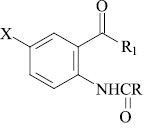
|
Номер соединения |
X |
R |
R1 |
рКа |
рКв |
|
X |
Br |
C6H4(4-NO2) |
NHCH2CH2CH(CH3)2 |
10,70 |
9,77 |
|
XI |
I |
C6H4 (4–CH3) |
NHCH2CH2CH(CH3)2 |
9,71 |
9,04 |
Таблица 5
Результат прогноза ГГА, доверительный интервал среднего предсказанного значения (Δинд, при р = 0,1), среднеквадратичная ошибка прогноза и экспериментальные значения ГГА
|
№ п/п |
ГГА 3 ч, % (уравнение (7)) |
ГГА 5 ч, % (уравнение (15)) |
||||
|
ГГА 3 чрассч (Δинд) |
ГГА 3 чэксп |
S1прогн (ур-е (7)) |
ГГА 5 чрассч (Δинд) |
ГГА 5 чэксп |
S3прогн (ур-е (15)) |
|
|
X |
–13,47 (–22,21...–4,72) |
–17,50 ± 1,19 |
5,39 |
+1,38 (–3,16...+5,92) |
–6,70 ± 5,58 |
4,47 |
|
XI |
–16,37 (–22,34...–10,39) |
–9,90 ± 3,75 |
–8,02 (–11,13...–4,92) |
–4,60 ± 3,94 |
||
|
ГГА 3 ч, % (уравнение № 8) |
ГГА 5 ч, % (уравнение № 16) |
|||||
|
ГГА 3 чрассч (Δинд) |
ГГА 3 чэксп |
S2прогн (ур-е (8)) |
ГГА 5 чрассч (Δинд) |
ГГА 5 чэксп |
S4прогн (ур-е (16)) |
|
|
X |
–12,20 (–17,90...–6,49) |
–17,50 ± 1,19 |
5,58 |
–3,84 (–9,04...+1,35) |
–6,70 ± 5,58 |
2,56 |
|
XI |
–15,75 (–20,59...–10,90) |
–9,90 ± 3,75 |
–6,81 (–11,23...–2,40) |
–4,60 ± 3,94 |
||
Доверительный интервал прогноза ΔГГА 3 чрассч (уравнения (7) и (8)) ΔГГА 5 чрассч (уравнения (15) и (16)) по соединениям X и XI полностью включает в себя экспериментально определенные значения ГГА с учетом их отклонений (табл. 5).
Для проведения сравнительной оценки прогнозирования ГГАрассч, с помощью полученных уравнений (7), (8), (15) и (16) и рассчитанных квантово-химических параметров вычислены значения средней квадратичной ошибки прогноза (Sпрогн): S1прогн = 5,39, S2прогн = 5,58, S3прогн = 4,47 и S4прогн = 2,56 (табл. 5). Величина средней квадратичной ошибки свидетельствует о том, что использование уравнения (16) (S4прогн. = 2,56) приводит к более точным результатам прогнозирования ГГА 5 ч. Сравнительная оценка найденных уравнений (7) и (8) при прогнозировании ГГА выявила, что меньшую ошибку прогноза дает уравнение (7) (S1прогн = 5,39).
Приведенные в работе результаты позволяют сделать вывод о том, что найденные модели структура – гипогликемическая активность (уравнения (7) и (16)) могут быть использованы при конструировании соединений с гипогликемической активностью в ряду амидов N-ацил-5-бром(йод) антраниловых кислот.



