Известно, что при сгорании в воздухе нанопорошок (НП) алюминия взаимодействует с азотом с образованием нитрида алюминия [1], при этом на промежуточных стадиях горения выход нитрида алюминия выше, чем в конечных продуктах [2]. В условиях горения происходит дезактивация кислорода воздуха [3], и процесс азотирования алюминия происходит в течение определенного времени в определенном объеме, т.е. образуется только нитрид алюминия, который при охлаждении частично переходит в γ-оксид алюминия [4].
При комнатной температуре только литий взаимодействует с азотом воздуха, образуя Li3N, который окрашен в красно-коричневый цвет [5]. При комнатной температуре реакция с азотом протекает медленно, поэтому необходим поиск методов быстрого синтеза нитрида лития. При изучении конечных продуктов сгорания смеси нанопорошка алюминия с оксидами магния и кальция обнаружены кристаллические фазы, рефлексы которых были отнесены к кристаллам нитридов магния и кальция вытянутой формы [6, 7]. Учитывая, что оксиды щелочных металлов сильно гигроскопичны, вместо них для приготовления смесей с НП алюминия были использованы соответствующие карбонаты [8].
Цель работы – определение фазового состава промежуточных продуктов горения НП алюминия с добавками карбоната лития.
Материалы и методы исследования
В работе использовался НП алюминия, полученный с помощью электрического взрыва проводников в аргоне [9]. Схема установки для получения НП показана на рис. 1. Установка работает следующим образом: от высоковольтного источника питания – 1 заряжается емкостный накопитель энергии – 2. Механизм подачи проволоки – 3 обеспечивает автоматическую подачу взрываемого отрезка проволоки – 4 в межэлектродный промежуток. При достижении проволокой высоковольтного электрода – 5 срабатывает коммутатор – 6, происходит разряд накопителя на этот отрезок проволоки, и он взрывается. Образовавшийся порошок собирается в накопителе – 7. Очищенный от порошка газ с помощью вентилятора – 8 подается обратно в камеру – 9. Объем камеры перед работой вакуумируется, а затем заполняется требуемой газовой атмосферой. Эти функции выполняет система газового снабжения – 10.
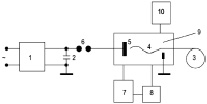
Рис. 1. Принципиальная схема установки для производства нанопорошков металлов в условиях электрического взрыва проводников
Нанопорошок алюминия, полученный в среде аргона, является пирофорным, т.е. воспламеняется при контакте с воздухом. Его пассивировали медленным окислением малыми добавками воздуха [9]. Нанопорошок алюминия характеризовался следующими параметрами активности: температура начала окисления 450 °С; степень окисленности 63,8 %; максимальная скорость окисления 0,13 мас. %/°С; удельный тепловой эффект 4995 Дж/г. В экспериментах использовали реактив оксида кальция (ч.д.а.).
Для выполнения качественного и количественного фазового анализа использовали дифрактометр ДРОН-3,0 [10]. Диапазон сканирования углов составлял 20–90 град. В работе применяли излучение медной трубки CuKα. Для идентификации кристаллических фаз использовали картотеку PDF-4. Предварительно продукты сгорания дезагрегировали и просеивали через сито с размером ячеек 63 мкм.
Дифференциальный термический анализ [11] (ДТА) проводили с использованием термоанализатора SDT Q600 Научно-аналитического центра ТПУ. Точность измерения температуры составляла 0,001 °С. Исходные смеси нанопорошка алюминия с карбонатом лития проверяли на пирофорность путем расчета по ДТА четырех параметров активности [12]: температура начала окисления (tн.о), максимальная скорость окисления (Vmax), степень окисленности (α), приведенный тепловой эффект (ΔH). Все приготовленные смеси имеют температуру начала окисления выше 300 °С, поэтому не пирофорны.
Электронный микроскопический анализ продуктов сгорания смеси нанопорошка алюминия с карбонатом лития проводили с использованием электронных микроскопов Jeol-840 и Hitachi SU8000. Перед съемкой образцы помещали на поверхность алюминиевого столика диаметром 25 мм, фиксировали при помощи проводящего клея. Морфологию образцов исследовали в естественных условиях, чтобы исключить поверхностные эффекты от напыления проводящего слоя [13–14]. Съемку изображений вели в режиме регистрации вторичных электронов при ускоряющем напряжении 2 кВ и рабочем расстоянии 4–5 мм.
Навески нанопорошка алюминия и карбоната лития смешивали в боксе на кальке с использованием пробки, обернутой в кальку, так как неизвестны характеристики смесей, связанных с трением. Смешивание проводили до тех пор, пока не исчезала неравномерность в окраске смеси. Всего было приготовлено 4 образца, соотношение Li2CO3:НП Al = 0,5:3,5; 1:3; 2:2; 3:1. Нанопорошок без добавок использовали в качестве образца сравнения. Инициирование процесса горения осуществляли с помощью нихромовой спирали, через которую пропускали электрический ток, при этом навеске старались придать коническую форму. Процесс горения проходил на подложке из нержавеющей стали толщиной 2 мм.
Горение исследуемых смесей прекращали при достижении максимальной яркости раздавливанием образца двумя массивными стальными плитами.
Результаты исследования и их обсуждение
Для проверки нанопорошка алюминия и его смесей с карбонатом лития на пирофорность была исследована их термическая устойчивость. Образцы нагревали в воздухе со скоростью 10°/мин до 900 °С (Q 600). Термограммы образцов представлены на рис. 2, 3.
При нагревании НП алюминия в воздухе происходила десорбция молекул воды и газов. Повышение температуры приводило к окислению алюминия (430 °С). Процесс окисления происходил в режиме теплового взрыва [15]. После температурного интервала нагрева НП алюминия с замедлением окисления при дальнейшем нагревании происходило ускорение окисления (рис. 2).
Введение в НП алюминия добавок Li2CO3 привело к появлению экзоэффекта с максимумом при 711 °С, интенсивность которого усиливалась по мере увеличения содержания добавки. Согласно термограммам смесей НП алюминия с карбонатом лития этот экзоэффект обнаруживается (максимум 711 °С) после разложения карбоната лития (680 °С). По расчетам разложение карбоната лития – эндотермический процесс с поглощением 226,3 кДж/моль.
В промежуточных продуктах сгорания образца смеси с максимальным содержанием карбоната лития после прерывания горения наблюдали кольцо продуктов красно-коричневого цвета (рис. 4), что является подтверждением наличия в продуктах сгорания нитрида лития. Температура в зоне горения превышала температуру разложения нитрида лития (400 °С). Температура в зоне горения НП алюминия превышала 2000 °С, поэтому в центре образца нитрид лития не сохранился: температура его разложения 440 °С.
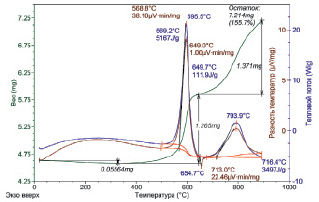
Рис. 2. Термограмма исходного нанопорошка алюминия (обр. 4:0, атмосфера – воздух, скорость нагрева 10 °С/мин, масса навески 4,634 мг)
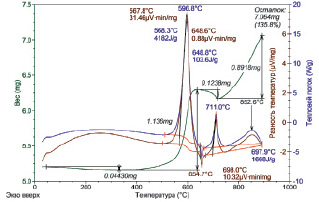
Рис. 3. Термограмма смеси нанопорошка алюминия с карбонатом лития (обр. 3,5:0,5, атмосфера – воздух, скорость нагрева 10 °С/мин, масса навески 5,202 мг)

Рис. 4. Фотография промежуточных продуктов горения смеси нанопорошка алюминия с карбонатом лития (образец 1:3)
Согласно полученным данным (табл. 1) с увеличением содержания карбоната лития в смеси температура начала окисления возрастала с 330 до 370 °С, при этом максимальная скорость окисления снижалась с увеличением содержания карбоната лития, для образца 1:3 она снизилась на 97 %. Степень окисленности алюминия в смесях ниже, чем у исходного НП алюминия: для образца 1:3 она снизилась на 82 %. Удельный тепловой эффект с ростом содержания карбоната лития также снижался, для образца 1:3 он снизился на 75 %.
Таблица 1
Параметры активности смесей нанопорошка алюминия и карбоната лития
|
Соотношение НП Al к Li2CO3 |
Параметры активности смесей |
||||
|
Температура начала окисления, °С |
Максимальная скорость окисления, мг/мин |
Степень окисленности, % |
Удельный тепловой эффект окисления смеси, Дж/г |
Удельный тепловой эффект алюминия*, Дж/г |
|
|
4:0 |
330 |
0,15 |
0,28 |
5167 |
5167 |
|
3,5:0,5 |
340 |
0,14 |
0,23 |
4182 |
4521 |
|
3:1 |
360 |
0,13 |
0,19 |
3953 |
3875 |
|
2:2 |
360 |
0,01 |
0,13 |
2453 |
2583 |
|
1:3 |
370 |
0,01 |
0,05 |
995 |
1292 |
Примечание. * При расчетах α, ΔH введена поправка на содержание НП алюминия.
Таблица 2
Характеристики горения смесей нанопорошка алюминия и карбоната лития до максимальной яркости и промежуточных продуктов горения
|
№ п/п |
Состав образца НП Al:Li2CO3 |
Описание процесса горения |
Описание промежуточных продуктов горения |
|
1 |
3,5:0,5 |
– при горении наблюдались искры |
– на обеих пластинах присутствовал осадок оранжевого цвета; – наличие металлических «пластинок» в промежуточных продуктах |
|
2 |
3:1 |
– при горении наблюдались искры; – цвет пламени оранжево-красный |
– образования красного цвета на нижней пластине по кольцу |
|
3 |
2:2 |
– при поджигании образец «вспыхнул»; – горение протекало быстро |
– при горении наблюдались искры; – после горения остались следы коричневого цвета на пластинах; – промежуточные продукты сыпучие, но твердые |
|
4 |
1:3 |
– горение протекало медленно; – красный цвет пламени |
– при горении наблюдались искры; – продукты горения черного цвета; – образец прогорел не весь, спёкся |
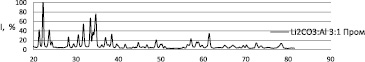

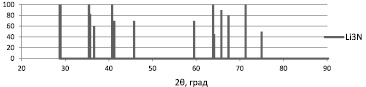
Рис. 5. Типичная рентгенограмма промежуточных продуктов горения смеси нанопорошка алюминия с карбонатом лития (образец 5) и штрихдиаграммы алюминия и Li3N (данные картотеки PDF-4)
Промежуточные продукты окисления (Li2O, Al2O3) не могут быть при нагревании окислены, поэтому наличие экзоэффекта объясняется как результат окисления металлического лития, восстановленного при высокой температуре НП алюминия и последующего формирования оксида или нитрида лития. Согласно термодинамическим расчетам, восстановление лития из оксида лития: 3Li2O + 2Al = Al2O3 + 6Li маловероятно (ΔG > 0). Наиболее вероятен процесс замещения атомов кислорода атомами азота при высокой температуре как это было обнаружено экспериментально при горении НП алюминия. Энтальпия образования Li2O и Li3N составляют –1191 и –328 кДж/моль соответственно.
На рис. 5 представлена типичная рентгенограмма промежуточных продуктов горения смеси нанопорошка алюминия с карбонатом лития и штрихдиаграммы нанопорошка алюминия и нитрида алюминия.
Заключение
Согласно проведенным экспериментам добавка карбоната лития повышает температуру начала окисления (табл. 1) с 330 (для НП алюминия без добавок) до 370 °С (образец 1:3). С введением добавки карбоната лития максимальная скорость окисления сначала повышалась на 23 %, а затем резко снизилась на 87 %. Степень окисленности образцов практически не изменялась, но для образца 1:3 резко уменьшилась на 36 %. Удельный тепловой эффект изменялся неоднозначно: он был максимален для образца 3:1 (5270 Дж/г) и минимален для образца 1:3.
Для образца 3,5:0,5 на термограмме отмечено уменьшение массы навески и после температуры плавления алюминия экзоэффект с максимумом 711,0 °С (рис. на образец 3,5:0,5), который не наблюдался в образце НП алюминия без добавок (рис. 4:0). С увеличением содержания карбоната лития интенсивность экзоэффекта (717,7 °С) возрастала. В продуктах сгорания визуально был обнаружен продукт красно-коричневого цвета, а на рентгенограмме (рис. 5) обнаружено увеличение рефлексов, которые не совпадают (2θ < 30°) с рефлексами известных для продуктов сгорания НП алюминия фаз, поэтому наиболее вероятно кристаллическая фаза красно-коричневого цвета принадлежит фазе Li3N [5]. В условиях горения НП алюминия карбонат лития разложился (730 °С) и образовавшийся оксид лития восстановился до элементного состояния. При взаимодействии с воздухом литий образовал нитрид лития красно-коричневого цвета, и этот процесс сопровождался экзоэффектом, который отсутствовал на термограмме НП алюминия.
Увеличение интенсивности рефлекса при малых углах (2θ = 22°) связано с увеличением содержания карбоната лития, вероятно связано с формированием алюмината лития [8].



