На современном этапе развития сельскохозяйственного производства ассортимент химических и биологических средств защиты растений постоянно изменяется: исключаются препараты, вызывающие отдаленные экологические последствия, а список полезных средств пополняется эффективными соединениями новых механизмов действия в более безопасных препаративных формах. В последние годы из перечня пестицидов, применяемых в сельском хозяйстве, исключены высокотоксичные и персистентные препараты (ртутьсодержащие, хлорорганические, многие фосфорорганические и др.) [1].
К пестицидам ΧΧІ столетия относятся сульфонилмочевинные препараты и гетероциклические соединения разных рядов, в том числе пиридиновые гербициды, пиримидиновые инсектициды и фунгициды, гербициды на основе производных арилоксифеноксипропионовой кислот, имидазолиноновые гербициды, инсектициды классов фенилпиразолы и неоникотиноиды, триазоловые и имидазолиноновые фунгициды. Объем работ по синтезу этих соединений непрерывно растет, они успешно конкурируют по эффективности с применяемыми ранее пестицидами [2].
Наряду с использованием единичных пестицидов в сельском хозяйстве часто применяются их различные смеси. Комбинированные пестициды позволяют одновременно уничтожать сорняки, вредителей и болезни и являются важным резервом повышения биологической и экономической эффективности химических средств защиты растений. Известно, что применение комбинаций небольших доз двух или более пестицидов может обеспечить такую же биологическую эффективность и длительность действия, как и обработка большой дозой более токсичного препарата. Однако расширение одновременного использования пестицидов различных классов приводит к заметному загрязнению почвы, грунтовых, поверхностных, питьевых вод и сельскохозяйственной продукции [3].
Сложность и разнообразие состава пестицидных препаратов, большое количество мешающих веществ делают контроль над загрязнением водоемов пестицидами очень сложной аналитической задачей. Кроме того, состав применяемых пестицидов существенно изменяется во времени [4]. Поиск оптимальных методов анализа пестицидов – одна из важнейших проблем экологической аналитической химии. Для аналитического контроля остаточных количеств пестицидов в объектах сельского хозяйства и окружающей среды используют хромато-масс-спектрометрию, газовую хроматографию, электрохимические методы, полярографию, иммунно-ферментный анализ. Наибольшее применение в рутинных анализах получил метод высокоэффективной жидкостной хроматографии, но использование в качестве растворителей токсичных веществ и дорогостоящих реагентов обуславливает необходимость подбора соответствующих элюентов для хроматографического разделения и детектирования [5].
Целью настоящей работы являлась разработка оптимальных условий одновременного хроматографического разделения действующих веществ пестицидов различных химических классов.
Материалы и методы исследования
Хроматографические исследования проводили на жидкостном хроматографе фирмы «Applied Biosystems» (США), снабженном детектором спектрофотометрическим Applied Biosystems Kratos 757 с дейтериевой лампой. Рабочий диапазон от 190 до 360 нм, максимальная чувствительность 0,005 AUFS. Изократическое элюирование подвижной фазы осуществляли через колонку Reprosil-PUR ODS (размер 4×150 мм, зернение – 5,0 мкм). Для приготовления подвижной фазы использовали ацетонитрил «осч.» 1 сорт («Криохром», Россия), воду бидистиллированную (ТУ 6-09-2502-77) и кислоту ортофосфорную («х.ч.»). Для удаления пузырьков воздуха в подвижной фазе использовали дегазатор DG-18. В качестве объектов исследования были взяты стандартные образцы пестицидов (чистота > 98 %): имазапир (ГСО 7708-99), имидаклоприд (СОП 28-06), имазетапир (ГСО 8625-04), ципросульфамид (имп., «Bayer CropScience», Германия), метрибузин (ГСО 7713-99), фенмедифам (ГСО 7512-98), флумиоксазин (имп., «Sumitomo Chemical CO.», Япония), хизалофоп-П-этил (СОП 63-06), этофумезат (ГСО 7740-99), ипродион (СОП 8-05), флуфенацет (имп., «Bayer Crop-Science», Германия), флубендиамид (имп., «Bayer CropScience», Германия), фамоксадон (имп., «Дюпон де Немур Интернэшнл», Швейцария), пенцикурон (СОП 109-11), дифлуфеникан (имп., «Bayer СropScience», Германия). Стандартные растворы пестицидов с концентрацией 100 мкг/мл готовили из сухих образцов, используя в качестве растворителя ацетонитрил. Градуировочные растворы пестицидов хранили в рабочей камере холодильника при температуре +3–5 °С в герметично закрытых стеклянных емкостях не более 3 месяцев. Перед использованием растворы выдерживали при комнатной температуре не менее 20 мин. Рабочие растворы смеси пестицидов готовили путем разбавления стандартных растворов индивидуальных пестицидов ацетонитрилом непосредственно перед использованием. Обработку данных производили с помощью программного обеспечения Мультихром 1,5. Оптимальными условиями разделения компонентов разделяемой смеси являлось достижение хроматографической системой значений [6]: разрешения пиков Rs ≥ 1,0, фактора емкости 0,5 ≤ k’ ≤ 20, коэффициента асимметрии 0,7 ≤ As ≤ 1,5 и коэффициента селективности α ≥ 1,1.
Результаты исследования и их обсуждение
При выборе условий хроматографического разделения смеси исследуемых действующих веществ пестицидов учитывали физико-химические свойства разделяемых соединений (табл. 1).
Таблица 1
Краткая физико-химическая характеристика исследуемых действующих веществ пестицидов
|
Действующее вещество |
Класс |
Молекулярная масса |
Н |
log Kow |
|
Имазапир |
Имидазолиноны |
261,3 |
5 |
0,11 |
|
Имидаклоприд |
Неоникотиноиды |
255,7 |
0,6 |
0,57 |
|
Имазетапир |
Имидазолиноны |
289,3 |
5 |
1,49 |
|
Ципросульфамид |
Производные метоксибензамида |
374,0 |
8 |
0,8 |
|
Метрибузин |
Триазиноны |
214,3 |
0,1 |
1,65 |
|
Фенмедифам |
Карбаматы |
300,3 |
6 |
3,59 |
|
Флумиоксазин |
Фенилфталимиды |
354,3 |
10 |
2,55 |
|
Хизалофоп-П-этил |
Арилоксифеноксипропионаты |
372,8 |
9 |
4,61 |
|
Этофумезат |
Бензофуранилалкансульфонаты |
286,3 |
5 |
2,7 |
|
Ипродион |
Дикарбоксамиды |
330,2 |
5 |
3,1 |
|
Флуфенацет |
Оксиацетанилиды |
363,3 |
10 |
3,2 |
|
Флубендиамид |
Бензендиакарбоксамиды |
682,4 |
15 |
4,2 |
|
Фамоксадон |
Оксазолидиндионы |
374,4 |
12 |
4,8 |
|
Пенцикурон |
Производные мочевины |
328,8 |
13 |
4,68 |
|
Дифлуфеникан |
Карбоксамиды |
394,3 |
16 |
4,2 |
Все вещества представляют собой термически нестабильные, низкомолекулярные ароматические карбоциклические и гетероциклические соединения, содержащие в качестве заместителей как электроноакцепторные, так и электронодонорные группы. Для оценки степени гидрофильности и гидрофобности соединений использовали критерий гидрофобности Шатца (Н) и коэффициент распределения октанол-вода (logP), которые рассчитывали по формулам
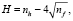 (1)
(1)
где nh – число элементарных гидрофобных фрагментов в молекуле, а nf – число полярных групп.
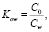 (2)
(2)
Co – концентрация тестируемого вещества в н-октаноле, насыщенном водой, а Cw – концентрация тестируемого вещества в воде, насыщенной 1-октанолом.
Все исследуемые действующие вещества пестицидов относятся к низко- (Н = 0–4) и среднегидрофобным (Н = 4–20) веществам, которые соответственно частично растворимы в воде и хорошо растворимы в полярных растворителях. Учитывая данные характеристики, наиболее эффективным является использование обращенно-фазового варианта жидкостной хроматографии. В качестве неподвижной фазы использовали хроматографическую колонку, содержащую сорбент на основе силикагеля, химически модифицированный алкилсиланами  , где R – алкильная цепь с восемнадцатью атомами углерода или октадецилсилированный силикагель. В качестве подвижной фазы использовали смесь ацетонитрила с 0,01 М раствором ортофосфорной кислоты в различных соотношениях (4:1, 7:3, 3:2, 1:1). Учитывая, что исследуемые действующие вещества пестицидов термически нестабильны, температура термостата колонки не превышала 40 °С. Согласно методическим указаниям по определению остаточных количеств индивидуальных пестицидов, была выбрана длина волны детектора 230 нм. При данной длине волны исследуемые соединения дают максимальный отклик. Изучали хроматографическую подвижность исследуемых действующих веществ пестицидов и определяли время удерживания при различном составе элюента. Результаты хроматографирования в системах с различным содержанием реагентов, как среднее пяти параллельных определений, представлены в табл. 2.
, где R – алкильная цепь с восемнадцатью атомами углерода или октадецилсилированный силикагель. В качестве подвижной фазы использовали смесь ацетонитрила с 0,01 М раствором ортофосфорной кислоты в различных соотношениях (4:1, 7:3, 3:2, 1:1). Учитывая, что исследуемые действующие вещества пестицидов термически нестабильны, температура термостата колонки не превышала 40 °С. Согласно методическим указаниям по определению остаточных количеств индивидуальных пестицидов, была выбрана длина волны детектора 230 нм. При данной длине волны исследуемые соединения дают максимальный отклик. Изучали хроматографическую подвижность исследуемых действующих веществ пестицидов и определяли время удерживания при различном составе элюента. Результаты хроматографирования в системах с различным содержанием реагентов, как среднее пяти параллельных определений, представлены в табл. 2.
Таблица 2
Времена удерживания действующих веществ пестицидов при различном составе подвижной фазы (n = 5, Р = 0,95)
|
Система элюирования Действующее вещество |
Время удерживания, мин |
|||
|
СН3CN/ 0,01М H3PO4 (4:1) |
СН3CN/ 0,01М H3PO4 (7:3) |
СН3CN/ 0,01М H3PO4 (3:2) |
СН3CN/ 0,01МH3PO4 (1:1) |
|
|
Имазапир |
– |
– |
2,735 |
6,861 |
|
Имидаклоприд |
– |
– |
2,964 |
6,681 |
|
Имазетапир |
– |
2,951 |
3,403 |
9,312 |
|
Ципросульфамид |
3,234 |
3,032 |
3,705 |
12,012 |
|
Метрибузин |
– |
4,311 |
4,420 |
13,375 |
|
Фенмедифам |
3,876 |
5,304 |
5,957 |
24,645 |
|
Флумиоксазин |
4,458 |
6,982 |
6,368 |
28,234 |
|
Хизалофоп-П-этил |
5,653 |
7,321 |
7,699 |
32,912 |
|
Этофумезат |
6,234 |
7,512 |
8,714 |
38,042 |
|
Ипродион |
7,231 |
8,612 |
9,702 |
43,612 |
|
Флуфенацет |
8,342 |
9,432 |
10,663 |
45,453 |
|
Флубендиамид |
9,054 |
10,234 |
11,425 |
45,567 |
|
Фамоксадон |
11,321 |
12,241 |
15,008 |
46,921 |
|
Пенцикурон |
14,765 |
15,442 |
18,245 |
49,925 |
|
Дифлуфеникан |
15,076 |
17,453 |
21,243 |
– |
Из табл. 2 видно, что при элюенте содержащем 80 % ацетонитрила и 20 % 0,01 М раствора ортофосфорной кислоты действующие вещества пестицидов с низким значением критерия Шатца и коэффициентом октанол-вода не детектируются. Имазапир, имидаклоприд, имазетапир и метрибузин сорбируются необратимо, т.е. система имеет недостаточную элюирующую силу по отношению к этим веществам. При уменьшении ацетонитрила в подвижной фазе до 70 % аналогичная картина наблюдается для имазапира и имидаклоприда, остальные действующие вещества пестицидов разделяются. При составе подвижной фазы 60 % ацетонитрил и 40 % 0,01 М раствор ортофосфорной кислоты все действующие вещества пестицидов разделяются, хроматограммы характеризуются достаточно узкими пиками. При дальнейшем уменьшении объемной доли ацетонитрила в подвижной фазе – время выхода действующих веществ пестицидов значительно увеличивается, а для некоторых веществ, таких как дифлуфеникан, время удержания не определено.
В результате полное разделение исследуемых веществ достигалось при следующих условиях: подвижная фаза (ацетонитрил – 0,01 М ортофосфорная кислота в соотношении 3:2 по объему) в изократическом режиме; скорость потока 0,5 мл/мин, температура термостата колонки – 40 °С. Длина волны детектирования – 230 нм, объем вводимой пробы – 10 мкл. Продолжительность анализа – 35 мин. На рисунке представлена хроматограмма смеси стандартных веществ, полученная при данных условиях.
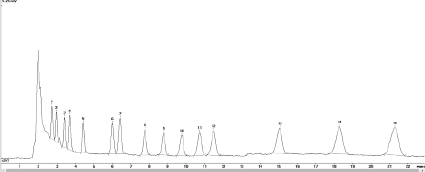
Хроматограмма стандартной смеси пестицидов: 1 – имазапир, 2 – имидаклоприд, 3 – имазетапир, 4 – ципросульфамид, 5 – метрибузин, 6 – фенмедифам, 7 – флумиоксазин, 8 – хизалофоп-П-этил, 9 – этофумезат, 10 – ипродион, 11 – флуфенацет, 12 – флубендиамид, 13 – фамоксадон, 14 – пенцикурон, 15 – дифлуфеникан
При выборе оптимальных условий разделения и идентификации веществ в смеси исследовали зависимость между составом подвижной фазы и хроматографическими параметрами (Rs – разрешение пиков, α – коэффициент селективности, As – коэффициент асимметрии, k' – фактор удерживания (ёмкости), N – число теоретических тарелок). Результаты расчета хроматографических характеристик представлены в табл. 3.
Таблица 3
Параметры хроматографического разделения действующих веществ пестицидов
|
Действующее вещество |
Rs |
α |
As |
k' |
N |
|
Имазапир |
1,48 2,79 1,71 3,82 7,15 1,65 4,73 3,20 2,89 2,60 1,87 7,34 5,30 3,99 |
1,3 1,5 1,2 1,4 1,6 1,1 1,3 1,2 1,1 1,1 1,1 1,4 1,2 1,2 |
1,68 |
0,57 |
4174 |
|
Имидаклоприд |
1,11 |
0,59 |
6513 |
||
|
Имазетапир |
1,20 |
0,71 |
6619 |
||
|
Ципросульфамид |
1,20 |
0,86 |
6034 |
||
|
Метрибузин |
1,14 |
1,22 |
8811 |
||
|
Фенмедифам |
1,01 |
1,99 |
9436 |
||
|
Флумиоксазин |
1,04 |
2,19 |
9691 |
||
|
Хизалофоп-П-этил |
0,99 |
2,86 |
9595 |
||
|
Этофумезат |
0,93 |
3,37 |
10932 |
||
|
Ипродион |
0,91 |
3,85 |
11471 |
||
|
Флуфенацет |
0,90 |
4,35 |
11879 |
||
|
Флубендиамид |
0,91 |
4,71 |
10614 |
||
|
Фамоксадон |
0,85 |
6,52 |
11671 |
||
|
Пенцикурон |
0,95 |
8,16 |
11256 |
||
|
Дифлуфеникан |
0,83 |
9,64 |
10289 |
При данных условиях хроматографирования значения разрешения пиков (R) находились в диапазоне от 1,48 до 7,34, что говорит о достаточно полном разделении двух соседних компонентов. Значения фактора удерживания (k') для исследуемых действующих веществ пестицидов составляли от 0,37 до 9,64, что характеризует их удерживание в колонке как оптимальное. При значении фактора разделения (α) ≥ 1,1 разделение считается полным. В нашем случае α находилось в диапазоне от 1,1 до 1,6, что говорит о правильном выборе сорбента в колонке и выборе растворителя в подвижной фазе. Величины коэффициентов асимметрии (As), рассчитанные для пиков исследуемых соединений, находились в диапазоне от 0,83 до 1,68, что свидетельствует об отсутствии значимых ионообменных взаимодействий. Число теоретических тарелок при данных условиях хроматографирования (N) находилось в диапазоне от 4174 до 11879, что свидетельствует о большом количестве установившихся равновесий и высокой эффективности хроматографической колонки. В подобранных оптимальных условиях хроматографирования получены градуировочные характеристики. Графики для каждого действующего вещества пестицидов имеют линейную зависимость с коэффициентами корреляции R2 ≥ 0,9978 (табл. 4). Стандартное отклонение градуировочных графиков Sr составляло от 3 до 10 %.
Таблица 4
Аналитические характеристики методики определения действующих веществ пестицидов (n = 5, Р = 0,95)
|
ДВ |
Время удерживания, мин |
Диапазон линейности, мкг/мл |
Уравнение градуировочного графика |
Коэффициент корреляции |
|
Имазапир |
2,70 |
0,03–4 |
у = 0,022100х |
0,9978 |
|
Имидаклоприд |
2,93 |
0,08–10 |
у = 0,081246х |
0,9986 |
|
Имазетапир |
3,36 |
0,04–5 |
у = 0,039133х |
0,9993 |
|
Ципросульфамид |
3,66 |
0,05–6 |
у = 0,036583х |
0,9996 |
|
Метрибузин |
4,37 |
0,02–3 |
у = 0,020694х |
0,9996 |
|
Фенмедифам |
5,89 |
0,02–3 |
у = 0,017073х |
0,9997 |
|
Флумиоксазин |
6,31 |
0,02–2 |
у = 0,009263х |
0,9998 |
|
Хизалофоп-П-этил |
7,64 |
0,05–6 |
у = 0,031069х |
0,9998 |
|
Этофумезат |
8,66 |
0,08–10 |
у = 0,058973х |
0,9997 |
|
Ипродион |
9,65 |
0,06–7 |
у = 0,041369х |
0,9996 |
|
Флуфенацет |
10,61 |
0,08–10 |
у = 0,049935х |
0,9997 |
|
Флубендиамид |
11,37 |
0,08–10 |
у = 0,036661х |
0,9997 |
|
Фамоксадон |
14,96 |
0,05–6 |
у = 0,018735х |
0,9998 |
|
Пенцикурон |
18,22 |
0,06–8 |
у = 0,017986х |
0,9996 |
|
Дифлуфеникан |
21,23 |
0,08–10 |
у = 0,018329х |
0,9996 |
Заключение
Таким образом, по результатам проведенного исследования подобран состав подвижной фазы и найдены оптимальные условия элюирования для идентификации действующих веществ пестицидов различных химических классов: имазапир, имидаклоприд, имазетапир, ципросульфамид, метрибузин, фенмедифам, флумиоксазин, хизалофоп-П-этил, этофумезат, ипродион, флуфенацет, флубендиамид, фамоксадон, пенцикурон, дифлуфеникан. Полученные данные свидетельствуют о том, что данный метод обеспечивает полное разделение и идентификацию исследуемых пестицидов, находящихся одновременно в смеси.



