Помимо антропогенного внесения, металлы присутствуют в природных средах в постоянном фоновом количестве. Микроорганизмы различного обитания способны выживать в присутствии металлов, однако именно металл-толерантные микроорганизмы отличаются особой устойчивостью к токсическому воздействию металлов. Такие организмы хорошо приспособлены и к широкому диапазону температур, pH, окислительно-восстановительному потенциалу участка, это связано с экстремальными условиями их естественных резервуаров: места залежей руд, гидротермальные источники, близость к действующим вулканам [1, 2].
Молекулярные механизмы, используемые микроорганизмами для выживания в богатых металлами средах, могут быть полезны человеку в различных областях биотехнологии, таких как биоремедиация загрязненных почвы и воды, добыча и обогащение полезных ископаемых. Например, применение металл-толерантных микроорганизмов в бактериально-химическом выщелачивании (БХВ) позволяет извлекать ценные компоненты из низкосортных, бедных руд или отходов горной добычи [3, 4].
В пульпах чанового БХВ концентрации ионов металлов могут превышать природные (например, в рудных месторождениях), они способны как ингибировать активность микробной популяции, угнетая её метаболизм, так и способствовать выработке микроорганизмами устойчивости к повышенным уровням металлов. Используя генетическую и метаболическую основы природных механизмов резистентности к металлам, учёные могут получить улучшенные штаммы биотехнологически значимых микроорганизмов [1, 4].
Большая продолжительность процессов БХВ является существенным недостатком и ставит перед учёными вопрос об интенсификации этих процессов. К вариантам решения данной проблемы относят повышение биоактивности микроорганизмов. Селекция наиболее активных смешанных и чистых культур, адаптированных к условиям протекания БХВ, позволит повысить эффективность извлечения ценных компонентов из сырья [5].
Задачей описанного в статье эксперимента являлась адаптация сообщества аборигенных микроорганизмов сульфидной кобальт-медно-никелевой руды к высоким «промышленным» концентрациям ионов кобальта в питательной среде и наблюдение за окислительной активностью адаптированной культуры. Стояла цель выявить, обладают ли клетки исследуемой культуры микроорганизмов, полученной из рудного месторождения, природными механизмами резистентности к токсическому воздействию кобальта.
Материалы и методы исследования
Эксперимент был проведен с использованием смешанной культуры мезофильных ацидофильных хемолитотрофных микроорганизмов (по данным ПЦР-диагностики НИГТЦ ДВО РАН в составе культуры идентифицированы Acidithiobacillus ferrooxidans, Sulfobacillus spp.). Источником культуры служила окисленная сульфидная кобальт-медно-никелевая руда (месторождение Шануч, Камчатский край, Россия). Для данной руды характерно содержание 60–90 % рудных минералов, где основной минерал – пирротин (60–75 %), менее выражены пентландит (20–25 %), виоларит (до 10 %), халькопирит (до 5 %), пирит (3–5 %); содержание Ni 3,9–4,2 %, Co 0,1 %, Cu 0,6–1,0 % (по данным рентгенофлуоресцентного анализа ЗАО НПК «Геотехнология»).
Количественный учёт клеток проводили прямым подсчетом под микроскопом в 10 полях зрения (микроскоп «Микромед-3», увеличение 1000х). Количество клеток в 1 мл среды рассчитывали по формуле
X = Nm•7,56•106, (1)
где X – число клеток в 1 мл, Nm – среднее арифметическое число в m полях зрения, 7,56•106 – коэффициент, рассчитанный с учетом объема анализируемой пробы (2 мкл), площади покровного стекла (576 мм2) и площади поля зрения (0,0132 мм2). В поле зрения микроскопа были видны морфологически однородные полупрозрачные одиночные подвижные палочки.
За окислительной активностью культуры наблюдали путём определения концентраций Fe2+ и Fe3+ в растворах питательной среды методом трилонометрического титрования трилоном Б. Методика определения Fe3+: в коническую колбу объемом 100 мл приливали 30 мл индикаторного раствора (смесь 20 % сульфосалициловой кислоты и 20 % соляной кислоты в дистиллированной воде) и вносили 1 мл анализируемой среды; нагревали до 70 °С на плитке и титровали раствором трилона Б до перехода окраски из красно-фиолетовой в лимонно-желтую и от одной избыточной капли в бесцветную (1 капля = 0,015 мл). Концентрацию Fe3+ (г/л) вычисляли по формуле
CFe3+ = (VТБ•(0,025•55,84)•1000):Vпробы , (2)
где VТБ – мл израсходованного на титрование раствора трилона Б, 0,025 – молярность трилона Б, 55,84 – атомная масса Fe.
Методика определения Fe2+: раствор, в котором оттитровано трехвалентное железо, вновь нагревали до 70 °С, добавляли 50 мг пероксодисульфата аммония (надсернокислого аммония), кипятили в течение 1 мин. Раствор изменял окраску на красно-фиолетовую, после чего его вновь титровали раствором трилона Б до перехода окраски в лимонно-желтую и от одной избыточной капли в бесцветную.
Добавляли несколько кристаллов надсернокислого аммония для проверки полноты окисления (стабильность окраски). Концентрацию Fe2+ вычисляли по той же формуле, что и концентрацию Fe3+.
Адаптация к высоким содержаниям ионов кобальта
Высокие концентрации ионов кобальта были достигнуты добавлением CoSO4•7H2O в состав минеральной питательной среды 9К [6], содержащей FeSO4•7H2O. Был получен ряд концентраций: 12, 14, 16, 18, 20 г/л Co.
В колбы Эрленмейера, где была питательная среда (с) с указанными выше концентрациями ионов кобальта, произвели посев культуры (к) (Nкл. = 1,2•108 кл/мл) в соотношении к:с = 1:10. В том же соотношении культура была внесена в контрольную колбу (К), где содержалась «чистая» среда 9К без ионов кобальта. pH всех сред до посева и культивирования – 1,6.
Посевы культивировали в термостате при 29 °С в течение 5 суток, аэрацию среды осуществляли постоянным перемешиванием с помощью качалки (≈ 110 об/мин). Затем в течение 10 суток культивировали статично (без перемешивания) при комнатной температуре.
Окислительная активность культуры
Окислительную активность исследуемой культуры микроорганизмов рассматривали для образца, адаптированного к 20 г/л ионов Co. На момент окончания адаптации и пересева культуры в «чистую» питательную среду 9К, количество клеток в ней составляло 5,6•107 кл/мл. Источник железа в среде – FeSO4•7H2O. В колбы Эрленмейера произвели посев в соотношении к:с = 1:10, в трех повторениях (Co I, Co II, Co III).
Культивировали в течение 7 суток в термостате (29 °С), аэрацию среды осуществляли перемешиванием на качалке (≈ 110 об/мин) в 0–3 и 6–7 сутки эксперимента.
Результаты исследования и их обсуждение
Адаптация к высоким содержаниям ионов кобальта
Присутствие ионов кобальта в питательной среде 9К в каждой установленной концентрации (12, 14, 16, 18, 20 г/л) не оказало губительного воздействия на рост культуры микроорганизмов; сохранение жизнеспособности указывает на наличие в клетках природных механизмов резистентности к токсическому воздействию кобальта. С ростом культуры первоначальный pH среды повысился с 1,6 до 2,1–2,3 и оставался таким на протяжении всего периода адаптации.
По данным табл. 1 можно видеть, что ионы кобальта ингибировали рост культуры только в начале или первой половине периода адаптации (1 сутки для концентраций Co 12 и 14 г/л; 1–5 сутки для концентраций Co 16 и 18 г/л; 1–9 сутки для концентрации Co 20 г/л) в сравнении с контрольным ростом в чистой питательной среде. Затем численность клеток в адаптируемых образцах превосходила численность контроля.
Таблица 1
Численность клеток культуры в период адаптации к высоким концентрациям ионов кобальта в питательной среде
|
Концентрация ионов Co, г/л |
Количество клеток, •107 кл/мл |
|||||||
|
1 сутки |
3 сутки |
5 сутки |
7 сутки |
9 сутки |
11 сутки |
13 сутки |
15 сутки |
|
|
К (0) |
2,1 |
4,2 |
4,6 |
4,6 |
4,8 |
4,8 |
5,2 |
5,1 |
|
12 |
0,45 |
4,6 |
5,0 |
5,3 |
5,9 |
6,2 |
6,7 |
7,0 |
|
14 |
1,7 |
5,7 |
5,6 |
5,9 |
6,2 |
6,3 |
6,8 |
6,8 |
|
16 |
1,5 |
1,9 |
2,6 |
4,6 |
4,6 |
5,1 |
5,6 |
5,5 |
|
18 |
0,98 |
1,9 |
3,1 |
4,7 |
5,2 |
5,8 |
5,9 |
6,3 |
|
20 |
1,1 |
0,98 |
2,3 |
3,1 |
4,4 |
5,2 |
5,6 |
6,5 |
Для дальнейшего хода исследования (наблюдения за окислительной активностью микроорганизмов) был выбран образец, адаптированный к 20 г/л ионов Co, как устойчивый к самой высокой заявленной концентрации.
Окислительная активность культуры
В «чистой» питательной среде 9К адаптированная культура показывала медленный рост по сравнению с контролем в первые и вторые сутки эксперимента, уже к третьим суткам рост превысил контрольные показатели. К окончанию эксперимента (7 сутки) численность клеток контрольной культуры превосходила численность адаптированной (табл. 2, рис. 1). Показатель pH сохранялся в пределах 2,1–2,3.
Таблица 2
Численность клеток адаптированной культуры в «чистой» питательной среде 9К
|
Сутки |
Количество клеток, •107 кл/мл |
|||
|
К |
Co I |
Co II |
Co III |
|
|
1 |
0,68 |
0,60 |
0,30 |
0,30 |
|
2 |
0,50 |
0,50 |
0,83 |
0,50 |
|
3 |
0,84 |
2,19 |
1,82 |
1,63 |
|
6 |
1,74 |
3,34 |
1,52 |
2,12 |
|
7 |
4,02 |
3,41 |
2,58 |
1,90 |
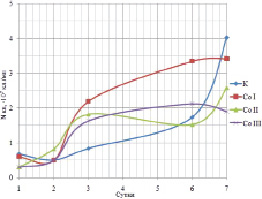
Рис. 1. Численность клеток адаптированной культуры в «чистой» питательной среде в сравнении с контролем
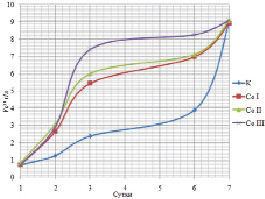
Рис. 2. Изменения концентрации Fe3+ (г/л) в питательной среде с адаптированной культурой в сравнении с контролем
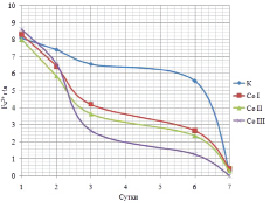
Рис. 3. Изменения концентрации Fe2+ (г/л) в питательной среде с адаптированной культурой в сравнении с контролем
Результаты измерений концентраций Fe3+ и Fe2+ представлены на рис. 2 и 3 соответственно; скорость окисления железа адаптированной культурой значительно превышала скорость окисления контрольной, вероятно, это связано с лучшим ростом клеток в первом случае. Однако для образца Co III характерно небольшое увеличение количества клеток в 3–7 сутки эксперимента, в то же время скорость окисления выше, чем у всех остальных образцов.
Необходимо отметить: несмотря на разницу в скоростях окисления адаптированной и контрольной культурами, железо питательного раствора (Fe2+) было окислено (до Fe3+) полностью или почти полностью к седьмым суткам эксперимента (рис. 3).
Заключение
Полученные экспериментальные данные позволяют сделать следующие выводы:
– исследованная смешанная культура мезофильных ацидофильных хемолитотрофных микроорганизмов (включающая Acidithiobacillus ferrooxidans, Sulfobacillus spp.) оставалась жизнеспособной и сохраняла рост в среде с добавлением ионов кобальта в диапазоне концентраций 12–20 г/л, вероятно клетки данной культуры обладают природными механизмами резистентности к токсическому воздействию кобальта в высоких концентрациях;
– в период адаптации к присутствию ионов кобальта в питательной среде культурой не была утрачена или ослаблена способность к окислению железа, напротив, скорость окисления такой культурой была выше контрольной, не подвергавшейся воздействию высоких концентраций ионов кобальта;
– несмотря на меньшую численность клеток на протяжении почти всего эксперимента и более низкую скорость окисления в сравнении с адаптированной культурой, контрольная культура «завершила» окисление всего доступного железа питательного раствора к седьмым суткам эксперимента, одновременно с адаптированной культурой.
Необходимо продолжать исследования полезного биотехнологического потенциала адаптированной культуры, интересным представляется опыт использования данной культуры в качестве биологического компонента чанового БХВ, потенциально интенсифицирующего биовыщелачивание металлов.



