Апитоксин (пчелиный яд) – аморфный порошок кремового цвета. Химический состав изучен достаточно полно: преобладают органические соединения, содержащие: углерод (43,6 %), водород (7,1 %), азот (13,6 %), серу (2,6 %) [1–3]. Неорганические вещества апитоксина составляют 3 % сухой массы и включают макроэлементы (фосфор, кальций, магний, медь), при этом натрий и калий отсутствуют. Большая часть химических компонентов [4, 5] исследована как с точки зрения химической структуры [6] и свойств, так и их физиологической активности [7].
Из физико-химических свойств оценены молекулярная масса, поверхностная активность [8, 9]. Показано, что мелиттин из мономера в растворе переходит в тетрамер, но при этом поверхностно-активные свойства сохраняются [10, 11]. Из факторов, влияющих на активность апитоксина, изучены: температура, свет, влага, O2, окислители и восстановители, ферменты [12].
Цель нашей работы: изучение влияния рН среды на вязкость растворов апитоксина, установление изоэлектрической точки и изучение его сорбционной способности по отношению к ионам свинца (11) (Pb 2+).
Молекулы полимера меняют свои физико-химические свойства под влиянием рН среды [13]. В кислой среде они существуют в виде полимерных катионов, в щелочной – полимерных анионов. При некотором рН, присущем разным по природе полимерам, макромолекула представляет собой полиамфион и находится в изоэлектрическом состоянии [14].
Цель исследования: определить изоэлектрическое состояние макромолекулы апитоксина.
Материалы и методы исследования
Определение изоэлектрической точки растворов апитоксина проводили капиллярным метолом с помощью капиллярного вискозиметра Оствальда [15].
Количество ионов свинца в фильтрате в различные промежутки времени определяли комплексонометрическим титрованием.
Комплексообразующую способность рассчитывали по отношению изменения массы связавшихся ионов свинца к массе сорбента.
Результаты исследования и их обсуждение
Для определения изоэлектрической точки растворов апитоксина использовали надежный и простой в исполнении метод по минимуму вязкости с помощью капиллярного вискозиметра Оствальда. Измеряли относительную вязкость серии ацетатных буферных растворов с добавлением одинакового количества апитоксина (0,8 %). В изоэлектрическом состоянии макромолекулы свернуты в клубок, наименее гидратированы. Поэтому минимальной вязкостью будет обладать раствор с рН, соответствующим изоэлектрическому состоянию.
Результаты эксперимента представлены в табл. 1 и на рис. 1.
Найденная величина изоэлектрической точки рН = 3,7 свидетельствует о том, что апитоксин является более сильной кислотой, чем основанием. У каждого полиэлектролита (белка) изоэлектрическая точка обычно соответствует рН среды, в которой функционирует белок. Это обстоятельство учитывается при технологических процессах, использующих его, влияет на скорость протекания физиологических процессов.
Таблица 1
Зависимость времени течения водных растворов апитоксина от рН среды
|
№ п/п |
рН буферного раствора |
Время t, с |
Относительная вязкость ηотн. |
|
1 |
H2O |
12 |
|
|
2 |
3,2 |
24,2 |
2,02 |
|
3 |
3,7 |
18,53 |
1,54 |
|
4 |
4,2 |
28,62 |
2,39 |
|
5 |
4,7 |
27,71 |
2,31 |
|
6 |
5,2 |
27,96 |
2,33 |
|
7 |
5,7 |
31,52 |
2,67 |
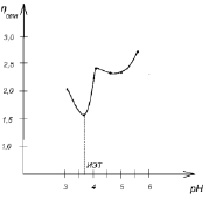
Рис. 1. Зависимость относительной вязкости растворов апитоксина от рН среды
В настоящее время актуален вопрос детоксикации организма с использованием природных сорбентов, освобождающих организм от эндогенных и экзогенных токсинов. Поэтому далее исследовали сорбционную емкость апитоксина по отношению к ионам свинца (II) и изучили кинетические характеристики процесса сорбции.
К навеске апитоксина (0,15 г) добавляли 10 мл 0,1 М раствора ацетата свинца и доводили водой очищенной до 100 мл.
Отфильтровывали образовавшийся рыхлый осадок. Количество ионов свинца в фильтрате в различные промежутки времени определяли комплексонометрическим титрованием.
Титрование проводили в среде ацетатного буферного раствора при рН = 5,5 в присутствии индикатора ксиленолового оранжевого.
Комплексообразующую способность рассчитывали по отношению изменения массы связавшихся ионов свинца к массе сорбента.
Результаты эксперимента представлены в табл. 2.
Таблица 2
Изменение концентрации Pb2+ после его сорбции на апитоксине
|
t, мин |
Объем титранта, мл |
Содержание Pb2+, мг |
Концентрация катиона Pb2+, ммоль/л |
Степень извлечения Pb2+, % |
Комплексообразующая способность, мг/г |
|
0 |
4,0 |
82,9 |
40,0 |
– |
– |
|
5 |
3,6 |
74,6 |
26,0 |
8,9 |
49,3 |
|
10 |
3,5 |
72,5 |
35,0 |
12,5 |
69,3 |
|
20 |
3,4 |
70,4 |
34,0 |
15,0 |
83,3 |
|
30 |
3,3 |
68,4 |
33,0 |
17,5 |
96,7 |
|
40 |
3,3 |
68,4 |
33,0 |
17,5 |
96,7 |
Результаты показали наличие сорбционной способности, которую количественно можно выразить величиной адсорбции (А). Экспериментальная адсорбция определялась отношением количества катионов свинца, сорбированных апитоксином (ΔС, ммоль/л), с учетом используемого объема раствора (V, л) к массе сорбента (m, кг). Коэффициент распределения (Кр) ионов свинца между раствором и сорбентом определяли по отношению величины предельной адсорбции к равновесной концентрации.
Было проведено соответствие экспериментальной адсорбции с величинами, рассчитанными по уравнениям Лэнгмюра и Фрейндлиха, и построены изотермы адсорбции.
Уравнение изотермы адсорбции Лэнгмюра:
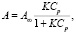
где А∞ – предельная адсорбционная емкость, ммоль/л;
Ср – равновесная концентрация ионов Pb2+, ммоль/л;
K – константа адсорбционного равновесия.
Постоянные параметры уравнения Лэнгмюра (А∞, K) определяли графически по зависимости 1/А от 1/Ср (рис. 2).
Константу адсорбционного равновесия находили в соответствии с зависимостью: 1/(А∞.K) = tgα.
Величина А∞ составила 14,3, К = 0,08.
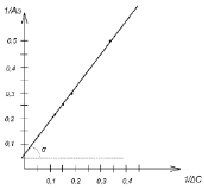
Рис. 2. Графическое определение констант уравнения Лэнгмюра
Для определения адсорбции по уравнению Фрейндлиха
А = K∙Cp1/n,
где K и 1/n – эмпирические константы,
уравнение логарифмировали:
lgA = lgK + 1/n lgCp
Константы определялись графически по зависимости lgA от lgCp.
При экстраполяции прямая отсекает от оси ординат отрезок равный lg K, а тангенс угла наклона его к оси абсцисс равен 1/n (рис. 3). Найденные величины констант составили: K = 0,93; 1/n = 0,84.
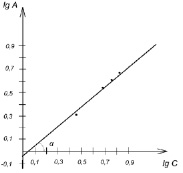
Рис. 3. Графическое определение констант уравнения Фрейндлиха
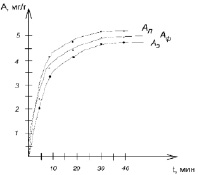
Рис. 4. Кинетика адсорбции ионов Pb2+
Результаты представлены в табл. 3.
Таблица 3
Зависимость величины адсорбции ионов Pb2+ от времени и концентрации
|
t, мин |
C Pb2+, ммоль/л |
ΔС |
АЭК |
1/АЭ |
1/ΔС |
lgАЭ |
lgΔC |
AЛ |
АФ |
АЭ/АЛ |
АЭ/АФ |
Кр |
|
0 |
40 |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
|
5 |
37 |
3 |
2,0 |
0,50 |
0,33 |
0,30 |
0,477 |
2,77 |
2,34 |
0,72 |
0,85 |
0,67 |
|
10 |
35 |
5 |
3,3 |
0,30 |
0,20 |
0,52 |
0,698 |
4,09 |
3,59 |
0,81 |
0,92 |
0,67 |
|
20 |
34 |
6 |
4,0 |
0,25 |
0,17 |
0,60 |
0,778 |
4,64 |
4,19 |
0,86 |
0,99 |
0,67 |
|
30 |
33 |
7 |
4,7 |
0,21 |
0,14 |
0,67 |
0,845 |
5,13 |
4,77 |
0,92 |
0,99 |
0,67 |
|
АЭ/АЛ(ср) = = 0,83 |
АЭ/АФ(ср) = = 0,94 |
Кр(ср) = = 0,67 |
Графическая интерпретация зависимости найденных величин адсорбции от времени представлена на рис. 4.
Соотношение величин адсорбции экспериментальной и рассчитанной по уравнениям близко к единице, что свидетельствует о применимости двух уравнений к исследуемым условиям адсорбции. Однако на рис. 4 видно, что к экспериментальной величине адсорбции ближе изотерма Фрейндлиха. Можно предположить, что поверхность сорбента неоднородная, пористая. Коэффициент распределения ионов Pb2+ между раствором и сорбентом составил 0,67.
Кинетические характеристики процесса сорбции, порядок реакции комплексообразования и константу скорости определяли по зависимости: lnC от t и ln (1-F) от t, где F – степень достижения равновесия в системе (рис. 5, 6). Данные для построения графиков, изображенных на рис. 5, 6, приведены в табл. 4.
Таблица 4
Зависимость lnC и ln (1-F) от времени
|
t, мин |
C Pb2+, ммоль/л |
lnC |
F = АЭ/А∞ |
ln (1-F) |
|
5 |
37 |
3,61 |
0,14 |
–0,151 |
|
10 |
35 |
3,56 |
0,23 |
–0,262 |
|
20 |
34 |
3,53 |
0,28 |
–0,328 |
|
30 |
33 |
3,50 |
0,33 |
–0,398 |
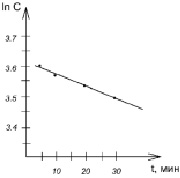
Рис. 5. Зависимость lnC от времени адсорбции
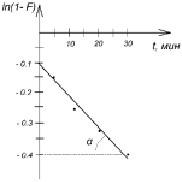
Рис. 6. Зависимость ln (1-F) от времени при сорбции ионов Pb2+
Линейность зависимости lnC от t позволяет утверждать, что процесс сорбции проходит по кинетике первого порядка. Найденная по тангенсу угла наклона прямой (рис. 6) к оси абсцисс константа скорости составила 0,011 мин-1.
Заключение
В результате исследования зависимости относительной вязкости растворов апитоксина от рН среды показано, что апитоксин относится к полиэлектролитам, изоэлектрическая точка его соответствует рН = 3,7.
Установлено наличие сорбционной способности по отношению к ионам Pb2+. Получены величины адсорбции экспериментальные и рассчитанные по уравнениям Лэнгмюра и Фрейндлиха, построены изотермы адсорбции, показана применимость уравнений для описания процесса адсорбции. Степень извлечения ионов свинца составила 17,5 %, что свидетельствует о детоксикационной способности апитоксина по отношению к экзогенному токсину – катионам свинца.
Изучена кинетика процесса сорбции, установлено, что процесс сорбции проходит по кинетике первого порядка. Небольшая величина скорости свидетельствует о быстром протекании процесса сорбции, равновесие наступает в течение 30 мин.
Найденные параметры физико-химических величин позволяют изучать биологическую активность и прогнозировать возможные технологические процессы для практического использования апитоксина.
Апитоксин был предоставлен индивидуальным предпринимателем г. Майкопа Краснодарского края Сердиным Юрием Павловичем.



