Апитоксин (пчелиный яд) – аморфный порошок кремового цвета. Химический состав изучен достаточно полно: преобладают органические соединения, содержащие: углерод (43,6 %), водород (7,1 %), азот (13,6 %), серу (2,6 %) [1–3]. Неорганические вещества апитоксина составляют 3 % сухой массы и включают макроэлементы (фосфор, кальций, магний, медь), при этом натрий и калий отсутствуют. Большая часть химических компонентов [4, 5] исследована как с точки зрения химической структуры [6] и свойств, так и их физиологической активности [7].
Из физико-химических свойств оценены молекулярная масса, поверхностная активность [8, 9]. Показано, что мелиттин из мономера в растворе переходит в тетрамер, но при этом поверхностно-активные свойства сохраняются [10, 11]. Из факторов, влияющих на активность апитоксина, изучены: температура, свет, влага, O2, окислители и восстановители, ферменты [12].
Цель нашей работы: изучение влияния рН среды на вязкость растворов апитоксина, установление изоэлектрической точки и изучение его сорбционной способности по отношению к ионам свинца (11) (Pb 2+).
Молекулы полимера меняют свои физико-химические свойства под влиянием рН среды [13]. В кислой среде они существуют в виде полимерных катионов, в щелочной – полимерных анионов. При некотором рН, присущем разным по природе полимерам, макромолекула представляет собой полиамфион и находится в изоэлектрическом состоянии [14].
Цель исследования: определить изоэлектрическое состояние макромолекулы апитоксина.
Материалы и методы исследования
Определение изоэлектрической точки растворов апитоксина проводили капиллярным метолом с помощью капиллярного вискозиметра Оствальда [15].
Количество ионов свинца в фильтрате в различные промежутки времени определяли комплексонометрическим титрованием.
Комплексообразующую способность рассчитывали по отношению изменения массы связавшихся ионов свинца к массе сорбента.
Результаты исследования и их обсуждение
Для определения изоэлектрической точки растворов апитоксина использовали надежный и простой в исполнении метод по минимуму вязкости с помощью капиллярного вискозиметра Оствальда. Измеряли относительную вязкость серии ацетатных буферных растворов с добавлением одинакового количества апитоксина (0,8 %). В изоэлектрическом состоянии макромолекулы свернуты в клубок, наименее гидратированы. Поэтому минимальной вязкостью будет обладать раствор с рН, соответствующим изоэлектрическому состоянию.
Результаты эксперимента представлены в табл. 1 и на рис. 1.
Найденная величина изоэлектрической точки рН = 3,7 свидетельствует о том, что апитоксин является более сильной кислотой, чем основанием. У каждого полиэлектролита (белка) изоэлектрическая точка обычно соответствует рН среды, в которой функционирует белок. Это обстоятельство учитывается при технологических процессах, использующих его, влияет на скорость протекания физиологических процессов.
Таблица 1
Зависимость времени течения водных растворов апитоксина от рН среды
|
№ п/п |
рН буферного раствора |
Время t, с |
Относительная вязкость ηотн. |
|
1 |
H2O |
12 |
|
|
2 |
3,2 |
24,2 |
2,02 |
|
3 |
3,7 |
18,53 |
1,54 |
|
4 |
4,2 |
28,62 |
2,39 |
|
5 |
4,7 |
27,71 |
2,31 |
|
6 |
5,2 |
27,96 |
2,33 |
|
7 |
5,7 |
31,52 |
2,67 |
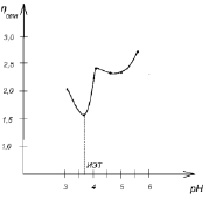
Рис. 1. Зависимость относительной вязкости растворов апитоксина от рН среды
В настоящее время актуален вопрос детоксикации организма с использованием природных сорбентов, освобождающих организм от эндогенных и экзогенных токсинов. Поэтому далее исследовали сорбционную емкость апитоксина по отношению к ионам свинца (II) и изучили кинетические характеристики процесса сорбции.
К навеске апитоксина (0,15 г) добавляли 10 мл 0,1 М раствора ацетата свинца и доводили водой очищенной до 100 мл.
Отфильтровывали образовавшийся рыхлый осадок. Количество ионов свинца в фильтрате в различные промежутки времени определяли комплексонометрическим титрованием.
Титрование проводили в среде ацетатного буферного раствора при рН = 5,5 в присутствии индикатора ксиленолового оранжевого.
Комплексообразующую способность рассчитывали по отношению изменения массы связавшихся ионов свинца к массе сорбента.
Результаты эксперимента представлены в табл. 2.
Таблица 2
Изменение концентрации Pb2+ после его сорбции на апитоксине
|
t, мин |
Объем титранта, мл |
Содержание Pb2+, мг |
Концентрация катиона Pb2+, ммоль/л |
Степень извлечения Pb2+, % |
Комплексообразующая способность, мг/г |
|
0 |
4,0 |
82,9 |
40,0 |
– |
– |
|
5 |
3,6 |
74,6 |
26,0 |
8,9 |
49,3 |
|
10 |
3,5 |
72,5 |
35,0 |
12,5 |
69,3 |
|
20 |
3,4 |
70,4 |
34,0 |
15,0 |
83,3 |
|
30 |
3,3 |
68,4 |
33,0 |
17,5 |
96,7 |
|
40 |
3,3 |
68,4 |
33,0 |
17,5 |
96,7 |
Результаты показали наличие сорбционной способности, которую количественно можно выразить величиной адсорбции (А). Экспериментальная адсорбция определялась отношением количества катионов свинца, сорбированных апитоксином (ΔС, ммоль/л), с учетом используемого объема раствора (V, л) к массе сорбента (m, кг). Коэффициент распределения (Кр) ионов свинца между раствором и сорбентом определяли по отношению величины предельной адсорбции к равновесной концентрации.
Было проведено соответствие экспериментальной адсорбции с величинами, рассчитанными по уравнениям Лэнгмюра и Фрейндлиха, и построены изотермы адсорбции.
Уравнение изотермы адсорбции Лэнгмюра:
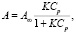
где А∞ – предельная адсорбционная емкость, ммоль/л;
Ср – равновесная концентрация ионов Pb2+, ммоль/л;
K – константа адсорбционного равновесия.
Постоянные параметры уравнения Лэнгмюра (А∞, K) определяли графически по зависимости 1/А от 1/Ср (рис. 2).
Константу адсорбционного равновесия находили в соответствии с зависимостью: 1/(А∞.K) = tgα.
Величина А∞ составила 14,3, К = 0,08.
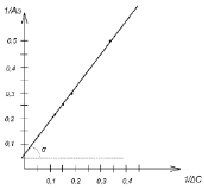
Рис. 2. Графическое определение констант уравнения Лэнгмюра
Для определения адсорбции по уравнению Фрейндлиха
А = K∙Cp1/n,
где K и 1/n – эмпирические константы,
уравнение логарифмировали:
lgA = lgK + 1/n lgCp
Константы определялись графически по зависимости lgA от lgCp.
При экстраполяции прямая отсекает от оси ординат отрезок равный lg K, а тангенс угла наклона его к оси абсцисс равен 1/n (рис. 3). Найденные величины констант составили: K = 0,93; 1/n = 0,84.
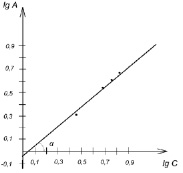
Рис. 3. Графическое определение констант уравнения Фрейндлиха
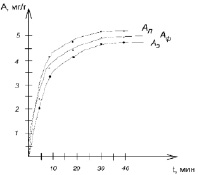
Рис. 4. Кинетика адсорбции ионов Pb2+
Результаты представлены в табл. 3.
Таблица 3
Зависимость величины адсорбции ионов Pb2+ от времени и концентрации
|
t, мин |
C Pb2+, ммоль/л |
ΔС |
АЭК |
1/АЭ |
1/ΔС |
lgАЭ |
lgΔC |
AЛ |
АФ |
АЭ/АЛ |
АЭ/АФ |
Кр |
|
0 |
40 |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
– |
|
5 |
37 |
3 |
2,0 |
0,50 |
0,33 |
0,30 |
0,477 |
2,77 |
2,34 |
0,72 |
0,85 |
0,67 |
|
10 |
35 |
5 |
3,3 |
0,30 |
0,20 |
0,52 |
0,698 |
4,09 |
3,59 |
0,81 |
0,92 |
0,67 |
|
20 |
34 |
6 |
4,0 |
0,25 |
0,17 |
0,60 |
0,778 |
4,64 |
4,19 |
0,86 |
0,99 |
0,67 |
|
30 |
33 |
7 |
4,7 |
0,21 |
0,14 |
0,67 |
0,845 |
5,13 |
4,77 |
0,92 |
0,99 |
0,67 |
|
АЭ/АЛ(ср) = = 0,83 |
АЭ/АФ(ср) = = 0,94 |
Кр(ср) = = 0,67 |
Графическая интерпретация зависимости найденных величин адсорбции от времени представлена на рис. 4.
Соотношение величин адсорбции экспериментальной и рассчитанной по уравнениям близко к единице, что свидетельствует о применимости двух уравнений к исследуемым условиям адсорбции. Однако на рис. 4 видно, что к экспериментальной величине адсорбции ближе изотерма Фрейндлиха. Можно предположить, что поверхность сорбента неоднородная, пористая. Коэффициент распределения ионов Pb2+ между раствором и сорбентом составил 0,67.
Кинетические характеристики процесса сорбции, порядок реакции комплексообразования и константу скорости определяли по зависимости: lnC от t и ln (1-F) от t, где F – степень достижения равновесия в системе (рис. 5, 6). Данные для построения графиков, изображенных на рис. 5, 6, приведены в табл. 4.
Таблица 4
Зависимость lnC и ln (1-F) от времени
|
t, мин |
C Pb2+, ммоль/л |
lnC |
F = АЭ/А∞ |
ln (1-F) |
|
5 |
37 |
3,61 |
0,14 |
–0,151 |
|
10 |
35 |
3,56 |
0,23 |
–0,262 |
|
20 |
34 |
3,53 |
0,28 |
–0,328 |
|
30 |
33 |
3,50 |
0,33 |
–0,398 |
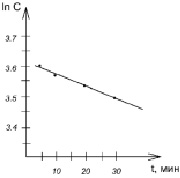
Рис. 5. Зависимость lnC от времени адсорбции
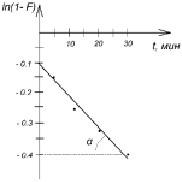
Рис. 6. Зависимость ln (1-F) от времени при сорбции ионов Pb2+
Линейность зависимости lnC от t позволяет утверждать, что процесс сорбции проходит по кинетике первого порядка. Найденная по тангенсу угла наклона прямой (рис. 6) к оси абсцисс константа скорости составила 0,011 мин-1.
Заключение
В результате исследования зависимости относительной вязкости растворов апитоксина от рН среды показано, что апитоксин относится к полиэлектролитам, изоэлектрическая точка его соответствует рН = 3,7.
Установлено наличие сорбционной способности по отношению к ионам Pb2+. Получены величины адсорбции экспериментальные и рассчитанные по уравнениям Лэнгмюра и Фрейндлиха, построены изотермы адсорбции, показана применимость уравнений для описания процесса адсорбции. Степень извлечения ионов свинца составила 17,5 %, что свидетельствует о детоксикационной способности апитоксина по отношению к экзогенному токсину – катионам свинца.
Изучена кинетика процесса сорбции, установлено, что процесс сорбции проходит по кинетике первого порядка. Небольшая величина скорости свидетельствует о быстром протекании процесса сорбции, равновесие наступает в течение 30 мин.
Найденные параметры физико-химических величин позволяют изучать биологическую активность и прогнозировать возможные технологические процессы для практического использования апитоксина.
Апитоксин был предоставлен индивидуальным предпринимателем г. Майкопа Краснодарского края Сердиным Юрием Павловичем.
Библиографическая ссылка
Бутенко Л.И., Мыкоц Л.П., Туховская Н.А., Степанова Н.Н., Сысоева Т.Н., Васина Т.М. НЕКОТОРЫЕ ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА АПИТОКСИНА // Успехи современного естествознания. 2019. № 2. С. 5-10;URL: https://natural-sciences.ru/ru/article/view?id=37049 (дата обращения: 08.01.2026).



