Одним из последствий применения химиотерапии при раке молочной железы (РМЖ), возможно, является повышенная частота диабета среди пациентов с РМЖ. Для снижения токсичности исследуемый синтетический цитостатик 4-(3´-гидрокси-4´-метоксифенил)кумарин (АС, аналог известного природного цитостатика комбретастатина А-4) был включен в липидный бислой липосом (Lp) в виде липофильного пролекарства - олеоильного производного (AC-Ole), полученного в соответствии со схемой 1.
С целью адресной доставки к опухоли липосомы оснащали тетрасахаридным лигандом селектинов, который встраивали в мембрану липосом (SiaLeX-PEG-DG). Известно, что селектины избирательно экспрессируются в районе роста опухоли на эндотелии сосудов, прорастающих de novo в опухоль. Целью работы было сравнить противоопухолевые эффекты липосомальных форм АС-Ole и исходного АС, а также проверить, может ли помочь включение цитостатика в липосомы избежать диабетоподобных явлений у пролеченных мышей-опухоленосителей.
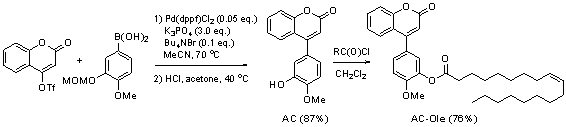
Схема 1
Липосомы на основе яичного фосфатидилхолина (PC) и фосфатидилинозита из S. cerevisiae (PI) в PBS получали методом последовательной экструзии через поликарбонатные фильтры с размерами пор 200 и 100 нм. Клетки культуры рака молочных желез Wnt-1 перевивали самкам линии C57BL/6 (106/мышь) сингенно. После появления пальпируемых опухолей мышам вводили в.в. 4-кратно с интервалом в неделю по 0.2 мл 7 мМ раствора АC (37 мг/кг) в РВS-5% Tween 80 (n=5), или дисперсий липосом состава PC/PI/AС-Ole(+/-SiaLeX-PEG-DG), 8:1:0.7:0.2) (мол.) в 1/3 экв. дозы по AС (n=6/7). Контрольная группа (n=5) получала одновременно в.в. по 0.2 мл буфера (PBS) на мышь. Противоопухолевый эффект оценивали по торможению роста опухолей и улучшению выживания опухоленосителей в течение трех месяцев после начала лечения. Уровень глюкозы в крови измеряли прибором Aссu-Chek Active (Roche, Germany).
В выбранном режиме введения ни одна из форм препарата не привела к достоверному улучшению рассматриваемых показателей по сравнению с контролем (табл. 1, 2). Однако, доля выживших мышей, пролеченных интактным препаратом, была несколько выше по сравнению с липосомальными формами
АС-Ole. На момент начала лечения, у около половины животных опухоли были размером не более 1 мм (0.6±0.3 мм), они составляли подгруппу 1 в своей группе. Самки с опухолями более 1 мм (1.9±0.7 мм) составляли подгруппу 2 в своей группе. Мыши с наименьшим начальным размером опухоли (подгруппа 1), пролеченные адресными липосомами, продемонстрировали тенденцию к замедлению роста опухоли (табл. 1) и улучшению выживания (табл. 2) по сравнению с контролями.
Гиперглюкозурия наблюдалась у пролеченных АС мышей уже после первого введения препарата. Тогда как введение липосомальных форм АС не привело к повышению уровня глюкозы в крови подопытных животных ни в начальные, ни в конечные сроки наблюдения.
Таблица 1
Динамика роста опухоли (диаметр, мм) в целом по группам и в подгруппе 1
|
|
n |
Группа/день* |
0 |
6 |
8 |
15 |
20 |
27 |
34 |
44 |
54 |
64 |
74 |
82 |
|
В целом |
5 |
PBS |
1.2 |
3.2 |
3.2 |
5.8 |
7.6 |
9.6 |
11.6 |
14.3 |
16.5 |
17.9 |
20.5 |
23.2 |
|
5 |
АС |
1.1 |
3.6 |
3.7 |
6.9 |
7.3 |
9.8 |
12.4 |
14.1 |
15.6 |
17.3 |
18.8 |
20.4 |
|
|
6 |
AC-Ole/Lp |
1.3 |
3.5 |
3.7 |
7.5 |
8.3 |
10.3 |
12.2 |
13.9 |
15.5 |
16.8 |
18.5 |
20.2 |
|
|
7 |
AC-Ole/Lp-SiaLeX |
1.1 |
3.0 |
3.8 |
5.3 |
6.1 |
8.05 |
9.9 |
12.1 |
14.3 |
13.8 |
16.0 |
18.2 |
|
|
Под-группа 1 |
3 |
PBS |
0.5 |
1.5 |
1.7 |
3.6 |
5.3 |
9.7 |
12.7 |
14.2 |
17.4 |
20.5 |
23.7 |
23.2 |
|
3 |
АС |
0.5 |
1.3 |
1.3 |
4.8 |
4.9 |
9.3 |
10.3 |
12.5 |
14.8 |
17.0 |
19.3 |
20.4 |
|
|
4 |
AC-Ole/Lp |
0.9 |
2.1 |
2.2 |
7.1 |
7.8 |
12.0 |
13.9 |
15.8 |
17.4 |
19.4 |
21.4 |
20.2 |
|
|
3 |
AC-Ole/Lp-SiaLeX |
0.6 |
1.0 |
1.3 |
2.1 |
2.0 |
5.9 |
8.4 |
10.9 |
13.3 |
15.8 |
18.3 |
18.2 |
* - дни после начала лечения.
Таблица 2
Параметры выживания (СПЖ, средняя продолжительность жизни)
|
|
Группы |
n |
СПЖ, дни |
Выживание, % |
|
В целом по группам |
PBS |
5 |
78.8 |
60 |
|
АС |
5 |
86.5 |
83 |
|
|
AC-Ole/Lp |
6 |
79.5 |
67 |
|
|
AC-Ole/Lp-SiaLeX |
7 |
83.5 |
67 |
|
|
Подгруппа 1 (начальный диаметр <1 мм) |
PBS |
3 |
79.7 |
67 |
|
АС |
3 |
77.0 |
67 |
|
|
AC-Ole/Lp |
4 |
86.8 |
75 |
|
|
AC-Ole/Lp-SiaLeX |
3 |
96.0 |
100 |
В итоге, было показано, что в используемой модели адресные липосомы с олеоильным производным 4-(3´-гидрокси-4´-метоксифенил)кумарина оказали наиболее выраженный противоопухолевый эффект, особенно в подгруппе с наименьшим размером опухолевых узелков на момент начала лечения. Введение препарата в виде липофильного пролекарства в липосомальной форме действительно снизило токсическое действие и диабетоподобные явления у мышей-опухоленосителей. Однако для достижения существенного противоопухолевого эффекта, по-видимому, следовало увеличить дозу препаратов за счет увеличения кратности инъекций.
Работа выполнена при финансовой поддержке проектов РФФИ №09-03-00647-a и МД-5606.2010.3.



