Реакции аминоиндолов с β-кетоэфирами могут протекать как с участием сложноэфирной группы, так и карбонильной с образованием либо индолиленаминоэфиров, либо индолиламидов или тех и других. Изучены реакции различно замещенных бензаминоиндолов с ацетоуксусным и трифторацетоуксусным эфирами в одинаковых условиях [1–18].
При этом для решения проблемы доказательства структуры продуктов реакции помимо спектров ЯМР приводились некоторые данные масс-спектральных характеристик. Поскольку наши исследования имели чисто синтетическую направленность, характер масс-спектрального распада не обсуждался.
Нами начаты испытания на биологическую активность полученных на основе аминоиндолов и бета-кетоэфиров енаминов и амидов [15–18]. При этом для доказательства строения исследуемых соединений наиболее удобным, на наш взгляд, является использование масс-спектрометрического метода.
В настоящем сообщении проводится анализ и выявление основных отличительных особенностей в поведении полученных нами индолиленаминов, индолиламидов под действием электронного удара и возможности использования данного метода при доказательстве их строения.
Одним из направлений диссоциативной ионизации енаминов 1-20 является элиминирование из молекулярного иона (М+) молекулы этилового спирта с образованием иона Ф, который, вероятнее всего, является молекулярным ионом соответствующего пирролохинолона, образующегося в условиях масс-спектральной съемки либо термически, либо под действием электронного удара.
Согласно приведенным в табл. 1 данным это направление распада является определяющим и хорошо согласуется с экспериментальными материалами о зависимости реакционной способности при проведении термической циклизации енаминов в зависимости от характера и расположения заместителей в бензольном и пиррольном кольцах индола. Все сказанное подтверждает схему масс-спектрального распада енаминоэфиров с участием бензольного кольца индола как основную. Образующийся ион Ф пирролохинолина устойчив к действию электронного удара.
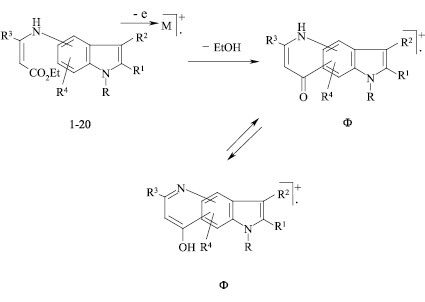
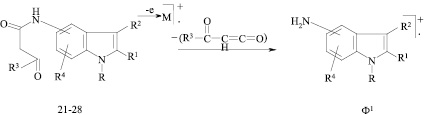
Свершенно по иному протекает масс-спектральный распад амидов 21-28, полученных из аминоиндолов и β-кетоэфиров. Основным направлением диссоциативной ионизации является элиминирование от молекулярного иона (М+) молекулы соответствующего дикетена с образованием молекулярного иона аминоиндола Ф1.
Образующийся ион аминоиндола исходя из интенсивности пика (100 %, см. табл. 2) стабилен к действию электронного удара, как и все ароматические амины [19].
Таблица 1
Значение Јотн в % для молекулярных М+ и фрагментных ионов Ф в масс-спектрах соединений 1-20
|
Соединения |
Масс-спектр, m/z (Јотн, %) |
|||||||
|
№ п/п |
NH |
R |
R1 |
R2 |
R3 |
R4 |
M+ |
Ф |
|
1 |
5-NH |
H |
Me |
Me |
CF3 |
H |
326 (100) |
280 (70) |
|
2 |
5-NH |
Me |
Me |
Me |
CF3 |
H |
340 (100) |
294 (67) |
|
3 |
5-NH |
H |
Me |
Me |
CF3 |
6-Me |
340 (100) |
294 (51) |
|
4 |
5-NH |
Me |
Me |
Me |
CF3 |
6-Me |
354 (82) |
308 (100) |
|
5 |
5-NH |
Me |
Me |
Me |
CF3 |
6-OMe |
370 (100) |
324 (50) |
|
6 |
5-NH |
H |
Ph |
H |
CF3 |
H |
374 (100) |
328 (82) |
|
7 |
5-NH |
H |
Ph |
H |
Me |
6-Me |
334 (68) |
288 (60) |
|
8 |
5-NH |
Me |
Ph |
H |
Me |
6-Me |
348 (100) |
302 (50) |
|
9 |
5-NH |
H |
Ph |
H |
CF3 |
6-Me |
388 (93) |
342 (100) |
|
10 |
5-NH |
Me |
Me |
Me |
Me |
6-Me |
300 (100) |
254 (46) |
|
11 |
5-NH |
Me |
Me |
Me |
Me |
6-OMe |
316 (100) |
270 (24) |
|
14 |
7-NH |
H |
Me |
Me |
Me |
H |
272 (100) |
226 (80) |
|
15 |
7-NH |
Me |
Me |
Me |
Me |
H |
286 (87) |
240 (100) |
|
16 |
6-NH |
Me |
Me |
Me |
Me |
7-OMe |
316 (100) |
270 (71) |
|
17 |
6-NH |
Me |
Me |
Me |
Me |
H |
286 (59) |
240 (100) |
|
18 |
6-NH |
H |
Me |
Me |
CF3 |
H |
326 (87) |
280 (100) |
|
19 |
6-NH |
Me |
Me |
Me |
CF3 |
H |
340 (36) |
294 (100) |
|
20 |
6-NH |
Me |
Me |
Me |
Me |
H |
316 (53) |
270 (100) |
Таблица 2
Значения Јотн в % для молекулярных M+ и фрагментных ионов Ф1 в масс-спектрах соединений 21-28
|
Соединения |
Масс-спектр, m/z (Јотн, %) |
|||||||
|
№ п/п |
NH |
R |
R1 |
R2 |
R3 |
R4 |
M+ |
Ф1 |
|
21 |
4-NH |
H |
H |
H |
Me |
H |
292 (50) |
208 (100) |
|
22 |
5-NH |
H |
Me |
Me |
CF3 |
7-Me |
312 (29) |
174 (100) |
|
23 |
5-NH |
Me |
Me |
Me |
CF3 |
7-Me |
326 (22) |
188 (100) |
|
24 |
6-NH |
H |
Me |
Me |
CF3 |
7-Me |
312 (11) |
174 (100) |
|
25 |
6-NH |
Me |
Me |
Me |
CF3 |
7-Me |
326 (11) |
188 (100) |
|
26 |
6-NH |
H |
Me |
Me |
CF3 |
5-OME |
328 (23) |
190 (100) |
|
27 |
6-NH |
Me |
Me |
Me |
CF3 |
5-OME |
342 (19) |
204 (100) |
|
28 |
6-NH |
H |
Me |
Me |
CF3 |
H |
312 (29) |
174 (100) |
Коренным образом в условиях электронного удара отличается поведение изомерных циклических амидов, образование которых нами обнаружено для ряда амининдолов. Основным направлением масс-спектрального распада амидов 29-35 является элиминирование от М+ трифторметильного радикала с образованием устойчивого иона Ф2 протонированного пирролохинолиндиона.
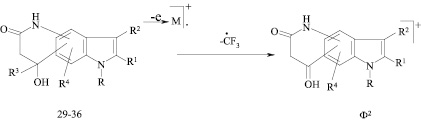
Таблица 3
Значение Јотн в % для молекулярных М+ и фрагментных ионов Ф в масс-спектрах соединений 29-36
|
Соединения |
Масс-спектр, m/z (Јотн %) |
|||||||
|
№ п/п |
NH |
R |
R1 |
R2 |
R3 |
R4 |
M+ |
Ф2 |
|
29 |
4-NH |
Me |
Me |
Me |
CF3 |
H |
312 (27) |
243 (100) |
|
30 |
4-NH |
H |
Ph |
H |
CF3 |
H |
346 (36) |
277 (100) |
|
31 |
6-NH |
H |
Me |
Me |
CF3 |
H |
298 (86) |
229 (100) |
|
32 |
6-NH |
H |
Me |
Me |
CF3 |
7-OCH3 |
328 (55) |
259 (100) |
|
33 |
6-NH |
Me |
Me |
Me |
CF3 |
7-OCH3 |
342 (83) |
273 (100) |
|
34 |
6-NH |
H |
Me |
Me |
CF3 |
5-CH3 |
312 (44) |
243 (100) |
|
35 |
6-NH |
H |
Ph |
H |
CF3 |
5-CH3 |
360 (98) |
291 (100) |
|
36 |
7-NH |
H |
Me |
Me |
CF3 |
H |
298 (47) |
229 (100) |
Основные масс-спектральные данные приведены в табл. 3.
Из приведенных данных по масс-спектрам соединений 1-36, выделенных в результате первичной реакции β-кетоэфиров (ацетоуксусного и трифторуксусного), можно судить о строении образующихся продуктов. Предположены основные схемы распада, по которым можно строго отличить енаминоэфиры 1-20, нециклические амиды 21-28, циклические амиды 29-36. Обнаруженные закономерности для соединений, образованных аминоиндолами, можно использовать и для идентификации аналогичных производных других ароматических аминов.
Масс-спектры получены на масс-спектрометре FINNIGAN MAT. INCOS-50 с прямым вводом образца в ионный источник при энергии ионизации 70 эВ и приведены в процитированных работах.
Библиографическая ссылка
Ямашкин С.А., Степаненко И.С., Котькин А.И. ИСПОЛЬЗОВАНИЕ РЕЗУЛЬТАТОВ МАСС-СПЕКТРОМЕТРИИ ПРИ ДОКАЗАТЕЛЬСТВЕ СТРОЕНИЯ ПРОДУКТОВ ПЕРВИЧНОЙ РЕАКЦИИ АМИНОИНДОЛОВ С Β-КЕТОЭФИРАМИ // Успехи современного естествознания. 2016. № 2. С. 76-79;URL: https://natural-sciences.ru/ru/article/view?id=35792 (дата обращения: 11.02.2026).



