Загрязнение водных экосистем опасными химическими соединениями стало глобальной экологической проблемой современности. Вот почему Генеральная Ассамблея ООН объявила 2005–2015 годы Международным десятилетием действий «Вода для жизни». Фенолы и хлорфенолы – вещества, оказывающие опасное воздействие на живые организмы, включая человека. Их относят к стойким органическим загрязнителям окружающей среды (COЗ) и они включены в список двенадцати СОЗ, полного уничтожения которых требует ратифицированная РФ Стокгольмская конвенция 2011 г. Фенол и хлорфенолы давно используются как антисептики, дезинфектанты, они входят в состав фунгицидов и пестицидов. В условиях медленной биодеградации эти вещества накапливаются в почве. Новой проблемой 21 века стало доказательство образования из хлорфенолов полихлорированных дибензодиоксинов и дибензофуранов [1]. Они токсичнее хлорированных фенолов, поэтому увеличение содержания данных веществ в окружающей среде, в первую очередь в продуктах питания, вызывает большое беспокойство [2].
Химические методы очистки позволяют частично или полностью разлагать фенолы и хлорфенолы или же переводить их в менее токсичные формы, способные к дальнейшей биодеградации. Одним из них является электрохимический метод анодного окисления. Исследования в области удаления фенола и хлорфенолов из водных растворов остаются актуальными, и они важны для разработки комплексных технологий очистки воды, которые могут включать и электрокаталитический метод. Традиционными являются платиновые электроды. Окисление производных хлорфенолов на Pt анодах изучено в диссертации [3]. Введение церия в состав PtTi электрода увеличивает скорость электрохимического окисления 4-хлорфенола и 2,4-дихлорфенола согласно результатам работы [4]. В электроокислении активны и металлоксидные аноды [5]. Оптимизация условий для получения высокой скорости окисления базируется на выборе фонового раствора, состава анода, а также анализе механизма сложного гетерогенного процесса.
Цель данной работы – используя метод циклической вольтамперометрии, определить кинетические характеристики анодного окисления фенола и 3-хлорфенола на платинированных титановых анодах с добавками церия и сурьмы.
Электроды, оборудование
Титановую фольгу (99 %) толщиной 100 мкм после специальных обработок подвергали платинированию в 0,1 М растворе тетранитрито-платината калия квалификации «х.ч.» в течение 1,5 ч при токе 40 мА, напряжении 21 В и рН6. Видимая поверхность анодов – 2 см2 (две стороны). Истинная поверхность анода определялась по пику водорода анодной ветви сернокислотного раствора. Для образца Pt/Ti коэффициент шероховатости поверхности равен 30, и он не изменился при модифицировании платины церием и сурьмой. Процент платины – 2,2 % от массы титана определен весовым методом. По данным энергодисперсионного анализа (рентгенофлуоресцентный спектрометр Clever-С31) в слое толщиной 1 мкм платины 15 % вес, от массы титана. Образцы СePt/Ti и SbPt/Ti были получены добавлением в раствор нитрата церия или нитрата сурьмы при тех условиях электроосаждения.
Потенциодинамические кривые (вольтамперограммы) регистрировали в фоновых растворах 0,5 М H2SO4 и 1 MNaOH при комнатной температуре, скорости развертки потенциала 100 мВ/с и различных начальных концентрациях вещества в интервале 0,01-0,1 мМ с использованием газо-диффузионной (аргон) 3-электродной ячейки с хлорсеребряным электродом сравнения. Для каждого образца результирующую IE кривую фиксировали после 20–30 циклирований на многофункциональном вольтамперметре ЭЛ-02, соединенном с компьютером (ошибка по току не более 5 %).
Результаты исследования и их обсуждение
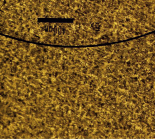
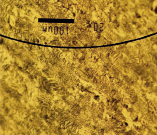
На рис. 1 показаны микрофотографии поверхности модифицированных электродов после электрохимических опытов, полученных с помощью электронного микроскопа Jeol JSM-6490LV.
|
Pt /Ti |
CePt /Ti |
SbPt /Ti |
Рис. 1. Морфология поверхности анодов (данные сканирующей электронной микроскопии)
На поверхности четко видны агрегаты платины, которые достаточно равномерно покрывают поверхность Ti-фольги (светлый фон). Также у Pt/Ti в виде крупных затемненных пятен видны области тонких пленок, по-видимому, углеродистых отложений. Рельеф покрытия анодов CePt/Ti и SbPt/Ti отличается от Pt/Ti: хорошо видно более равномерное распределение частиц платины в присутствии церия и сурьмы, а также отличие покрытия с сурьмой и церием. У образца SbPt/Ti можно рассмотреть вытянутые по форме кристаллы. Большая часть поверхности остается свободной от платины.
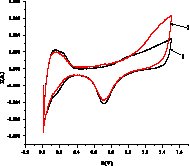
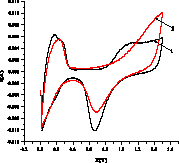
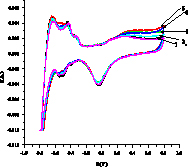
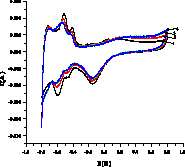
На рис. 2 показаны примеры вольтамперограмм для кислого (а,б) и щелочного (в,г) растворов 3-хлорфенола, из которых определяется ток I, мА в максимуме при 1,4 В в H2SO4 и 0,8 В в NaOH. Ток (скорость) окисления Iox – это разность между током I и током фона. Окисление субстрата Х начинается после окисления платины (образования оксида PtOx) и происходит с его участием Х + PtOx > Pt + Хox или Х + PtOx+1 > PtO + Хox согласно данным [6]. В левой части I-E кривой находятся области адсорбции/десорбции водорода, на катодной области при потенциалах около -0,1В (кислота) и 0,7 В (щелочь) мы видим пик разложения PtOx > Pt + Oадс с восстановлением платины и образованием адатома кислорода.
|
а |
б |
|
в |
г |
Рис. 2. Примеры вольтамперограмм окисления 3-хлорфенола в кислой среде на анодах CePt/Ti (а), SbPt/Ti (б) при концентрации 0,08 мМ (черная линия – фон, 0,5М H2SO4) и в щелочной среде на анодах CePt/Ti (в) и SbPt/Ti (г) при концентрациях 0,0164 (2), 0,032 (3), 0,0476 (4), 0,0625 (5), 0,0769 мМ, черная линия 1 – фон 1М NaOH
Из вольтамперограмм следует, что при окислении органического вещества ток увеличивается, значения Iox возрастают с ростом концентрации. Пики водородной области (Н1 и Н2 – две формы адсорбированного водорода) уменьшаются. Также уменьшается катодный пик кислорода. Это связано с блокировкой центров анода адсорбированными Х и продуктами окисления, способными к полимеризации. Аналогичный результат для фенола.
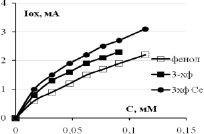
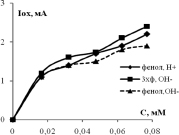
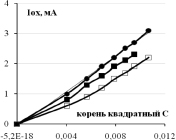
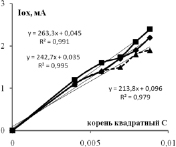
Зависимости тока (скорости) окисления от концентрации фенола и 3-хлорфенола показаны на рис. 3. Видно, что они нелинейные и порядок электроокисления меньше единицы. В координатах дробного порядка n = ½ получаются хорошие прямые линии с регрессионным коэффициентом R2 не хуже 0,95. Тангенс угла наклона прямой Iox = KC½ – это константа скорости электроокисления K1/2. Значения констант K1/2 для трех электродов и двух веществ приведены в табл. 1. Из данных таблицы видно, что K1/2 возрастают в ряду Pt /Ti < СеPt /Ti < SbPt /Ti. Значения K1/2 фенола и 3-хлорфенола отличаются: у 3ХФ они, как правило, больше по сравнению с фенолом, так в щелочной среде для анодов Pt/Ti на 18 % и для SbPt /Ti на 27 %, а в кислой среде у СеPt /Ti на 14 % и у SbPt /Ti на 90 %. Активность сурьмяно-платино-титанового анода воспроизводится, как видно из нижней строчки табл. 1.
|
а |
б |
|
в |
г |
Рис. 3. Концентрационные зависимости тока окисления фенола и 3-хлорфенола в кислой и щелочной среде для анодов, модифицированных церием и сурьмой
Таблица 1
Константы скорости K1/2 [мА*(л/моль)1/2] электроокисления фенола и 3-хлорфенола при комнатной температуре и скорости развертки потенциала 100 мВ/с
|
Среда |
Кислая среда |
Щелочная среда |
||
|
Электрод |
фенол |
3-ХФ |
фенол |
3-ХФ |
|
Pt /Ti |
190 |
195 |
198 |
233 |
|
СеPt /Ti |
209 |
238 |
241 |
246 |
|
SbPt /Ti |
245 |
275 |
203 |
258 |
|
SbPt /Ti* |
242 |
– |
214 |
263 |
Примечание: образец * проверен на воспроизводимость активности через 1 год.
Концентрационные зависимости скорости электроокисления с дробным кинетическим порядком можно объяснить адсорбцией из раствора ассоциированных форм субстрата (димеров и тримеров). Перед стадией электроокисления нужна диссоциация комплекса на поверхности электрода с образованием мономерной формы вещества. Эта стадия, по-видимому, и является лимитирующей стадией электроокисления в целом. Двухстадийную адсорбцию с диссоциацией комплекса, которая предшествует окислению, можно записать схемой Хm(раствор) - Хm(электрод) > mХадс > электроокисление. Учитывая распад молекулярных комплексов на электроде, мы получаем формальный порядок меньше единицы n = 1/m, где m – число молекул и нелинейные зависимости Iox–C.
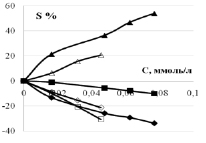
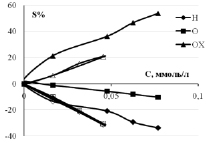
Теперь рассмотрим влияние начальной концентрации 3-хлорфенола на суммарные количества окисленного 3-хлорфенола (ОХ), адсорбцию/десорбцию водорода (Н), адсорбцию атомарного кислорода после разложения оксида платины (О). Промотирующий эффект добавок на примере церия проявляется и в этих характеристиках. Изменение адсорбции Н и О в условиях окисления показывает наличие на поверхности анода свободных центров для реакций Надс – е > Н+раствор в условиях кислой среды и PtO + e > Pt + Oадс. Площади пиков S определяются интегрированием соответствующих трех областей I–E кривых. Для корректного сравнения можно рассчитать относительное изменение площади пиков с учетом площади пиков фонового раствора по формуле S % = 100 (S-Sфон)/Sфон.
Как видно из рис. 4, для окисляемого вещества значения S % увеличивается с ростом концентрации (S % > 0), выше значения S % у образца с добавкой Ce (аналогично и для Sb). Значения S % водородной и кислородной областей отрицательные (S % < 0): уменьшение площади пиков связано с хемосорбцией субстрата, как уже мы писали выше, из-за которой активные центры поверхности блокированы. Концентрационные зависимости S % можно аппроксимировать прямыми линиями и рассчитать линейный градиент DS/DC как изменение площади соответствующих пиков. Эти значения приводятся в табл. 2. У анода СеPt/Ti линейный положительный градиент окисления DS/DC существенно больше, чем у Pt/Ti: в 663/437~2 раза в кислой среде и в 662/469 ~1,4 раза в щелочной среде.
|
а. 0,5 M H2SO4 |
б. 1M NaOH |
Рис. 4. Относительное изменение площади пиков I–E кривых в водородной, кислородной областях и области окисления 3-хлорфенола на анодах Pt/Ti (незакрашенные) и CePt/Ti (закрашенные значки) в кислом и щелочном фоновом растворе
Таблица 2
Линейный градиент площади пиков (DS/DC) окисления 3-хлорфенола, десорбции/адсорбции водорода и кислорода
|
Среда |
3ХФ, Н+ |
3ХФ, ОН- |
||
|
Анод |
Pt/Ti |
CePt/Ti |
Pt/Ti |
CePt/Ti |
|
ОХ |
+337 |
+663 |
+ 469 |
+ 662 |
|
Дес./Адс. Н |
– 320 |
– 413 |
– 686 |
– 409 |
|
Дес.О |
– 266 |
– 181 |
– 675 |
– 135 |
Отрицательный градиент кислорода уменьшается в присутствии церия, также как и для водорода в щелочной среде. Наибольшее изменение у кислорода в щелочном растворе 3ХФ: 675/135 = 5 раз, а у водорода только в 1,7 раза. Только в кислом растворе 3-ХФ у СеPt/Ti значение DS/DC для адсорбированного Н по модулю больше. Итак, введение церия и сурьмы увеличивает окислительную способность анода за счет снижения дезактивации центров адсорбции кислорода и/или облегчения распада оксида платины.
Ассоциаты фенола и 3-хлорфенола
Квантово-химические расчеты индивидуальных молекул и их молекулярных комплексов были проведены с использованием программы HyperChem 8.0.8. Хотелось понять, каково изменение межъядерных расстояний при ассоциации? Как влияет растворитель на длины связей O-C, С-Cl, водородной связи при помещении Х и их димеров в «водяной бокс» (метод AMBER с параметрами по умолчанию)? Некоторые комплексы оптимизированной геометрии показаны на рис. 5.
|
ассоциат 3ХФ с молекулой воды |
димер 3-ХФ |
тример фенола |
тример 3-ХФ |
Рис. 5. Комплексы оптимизированной геометрии
В табл. 3 приведены дипольные моменты μ, энергия нижней вакантной МО (знак «+» означает, что молекула нуклеофил, « – » электрофил), энергии связи фенольных молекул с водой ЕХ+Н2О, энергии водородной связи в димере ЕХ+Х и тримере Е`Х+Х+Х (` – на одну связь). В присутствии атома хлора энергия водородной связи в димере и тримере увеличивается. Энергия водородной связи димера 3ХФ (ЕХ+Х = 3,9 ккал/моль) в 2 раза больше, чем в ассоциате с водой (ЕХ+Н2О = 1,71 ккал/моль). Длина водородной связи у димеров и тримеров такая же, как и между фенольной молекулой и водой (1,83 A). Ассоциация наблюдается и с «растворенными молекулами»: рис. 6 демонстрирует димер 3ХФ в «боксе» с 48 молекулами воды. При «растворении» увеличение длин связей С-О и С-Cl небольшое (не более 1,6 и 5,2 % соответственно). Но для водородной связи О…Н в димере это увеличение существенное, оно составляет 10 % для фенола и 45 % для 3-ХФ.
Рис. 6. Димер 3ХФ в «боксе»
Таблица 3
Данные квантово-химических расчетов
|
Характеристика |
фенол |
3-ХФ |
|
Дипольный момент μ, Дб |
1,165 |
2,814 |
|
ЕНВМО , ккал/моль |
+ 0,246 |
– 0,246 |
|
ЕХ+Н2О , ккал/моль |
2,01 |
1,71 |
|
ЕХ+Х , ккал/моль |
2,1 |
3,9 |
|
Е`Х+Х+Х , ккал/моль |
3,5 |
4,6 |
Таким образом, ассоциаты фенола и 3-хлорфенола – это устойчивые структуры, и их присутствие в растворе влияет на процесс анодного окисления, кинетические параметры которого зависят от состава анода и среды. Церий и сурьма увеличивают активность платинированного титанового анода, снижая эффект блокировки поверхности прочно адсорбированным органическим веществом или продуктами его превращения.
Библиографическая ссылка
Салех М.М., Заев Д.А., Михаленко И.И. КИНЕТИКА ОКИСЛЕНИЯ ФЕНОЛА И 3-ХЛОРФЕНОЛА В ВОДНЫХ РАСТВОРАХ НА TI АНОДАХ С PT, СЕPT, SBPT ПОКРЫТИЯМИ // Успехи современного естествознания. 2017. № 5. С. 17-23;URL: https://natural-sciences.ru/ru/article/view?id=36448 (дата обращения: 17.02.2026).