Современная химия органического синтеза использует множество подходов и способов, связанных с усовершенствованием методик синтеза с целью повышения выхода целевых продуктов. Одним из прогрессивных способов, позволяющих оценить влияние изменения условий реакции (температура, растворители и т.д.) на её протекание, является использование квантово-химических расчётов с учетом влияния растворителя и температуры. Экспериментальный подход очень длителен и требует больших материальных затрат, а теоретический – позволяет моделировать оптимальные условия синтеза веществ, в частности провести модификацию методики реакции, подбирая температуру и растворитель.
При получении амидов антраниловой кислоты одним из методов получения является магнезиламинный способ, где в качестве исходного соединения используют метиловый эфир антраниловой кислоты в присутствии этилмагниййодида при нагревании в эфире. К его недостаткам относятся длительность процесса и использование абсолютного эфира, являющегося пожароопасным растворителем.
Известно несколько способов получения амидов антраниловой кислоты, в частности путем взаимодействия изатового ангидрида с анилином. Авторами [1] показано, что максимальный выход анилида антраниловой кислоты получен при нагревании дибромизатового ангидрида с трёхкратным избытком анилина в ледяной уксусной кислоте при соотношении изатовый ангидрид – уксусная кислота 1:150 (рис. 1).
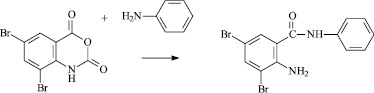
Рис. 1. Уравнение реакции амидирования изатового ангидрида анилином
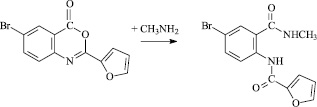
Рис. 2. Уравнение реакции амидирования 6-бром-2-фурил-3,1-бензоксазин-4(3Н)-она метиламином
Уксусная кислота позволяет осуществить процесс в условиях кислотного катализа благодаря протонированию гетероатома кислорода в третьем положении изатового ангидрида. Использование полярного апротонного растворителя – диметилсульфоксида (ДМСО) увеличивает нуклеофильные свойства исходного амина и при сочетании с кислотным катализом приведет к увеличению выхода соответствующего амида.
Другой способ подразумевает получение замещенных амидов антраниловой кислоты на основе 2-замещенных 3,1-бензоксазин-4(3Н)-онов [2, 3], реакция амидирования протекает при взаимодействии алифатических аминов с 2-замещенными 3,1-бензоксазин-4(3Н)-онами в среде 95 % этанола, например реакция амидирования 6-бром-2-фурил-3,1-бензоксазин-4(3Н)-она метиламином [2].
Цель работы заключается в теоретическом обосновании условий синтеза 4-метилфенил(бензил)амидов N-бензоил-5-бром(5-йод)антраниловых кислот с использованием квантово-химических расчётов (константы равновесия и энергии Гиббса активации реакции) с учетом влияния растворителя и изменения температурного режима на модели PCM (Polarizable Continuum Model) программой Gaussian 09.
4-Метилфенил(бензил)амиды N-бензоил-5-бром(5-йод)антраниловых кислот получены реакцией амидирования 6-бром(6-йод)-2-фенил-3,1-бензоксазин-4(3Н)-онов бензиламином и 4-метилфениламином (рис. 3).
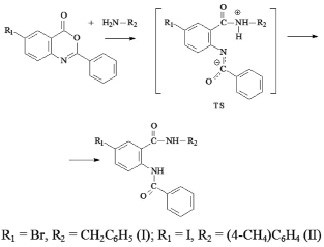
Рис. 3. Уравнение реакции амидирования, TS – переходное состояние
Материалы и методы исследования
Для поиска оптимальных условий синтеза 4-метилфенил(бензил)амидов N-бензоил-5-бром(5-йод)антраниловых кислот были проведены расчёты термодинамических параметров реакции амидирования: константы равновесия (Кравн.) и энергии Гиббса активации химической реакции (ΔGр.) (кДж/моль) (табл. 1). Квантово-химические параметры рассчитаны неэмпирическим методом Хартри – Фока в базисе 3-21G с полной оптимизацией геометрии молекул, с использованием программы Gaussian 09. Эффект растворителя учитывали, проводя расчёты на модели PCM.
Таблица 1
Рассчитанные константа (Кравн.) равновесия и энергия Гиббса активации реакции (ΔGр.) по соединениям I и II
|
Соед. |
t °C реакции |
25 |
79 |
25 |
100 |
120 |
|
Растворитель |
Этанол |
Уксусная кислота + ДМСО (1:1) |
||||
|
I |
Кравн. |
402,23 |
2,60×10–9 |
1,98 |
2524,88 |
1,98×1022 |
|
ΔGр. |
–14,86 |
–61,34 |
–1,70 |
–19,41 |
–158,00 |
|
|
II |
Кравн. |
–1,98×1015 |
–4,66×102 |
–1,28×1012 |
360,76 |
1,07×108 |
|
ΔGр. |
+87,29 |
+17,98 |
+86,48 |
–39,69 |
–57,35 |
|
Расчёт переходного состояния (TS) реакции (рис. 3) проводили в рамках метода IRC (Intrinsic Reaction Coordinate calculation) неэмпирическим методом Хартри – Фока в базисе 3-21G с полной оптимизацией геометрии молекул, с использованием программы Gaussian 09, получали два минимума, связанных седловой точкой (максимумом) – соответствует переходному состоянию [4].
Спектры 1Н ЯМР-соединений I–II записаны на спектрометре Mercury-300BB (рабочая частота прибора 300 МГц) в ДМСО-d6, внутренний стандарт – ГМДС. ИК-спектры соединений выполнены на спектрометре Specord M-80 в таблетках KBr. Элементный анализ проведен на приборе Perkin Elmer 2400. Данные элементного анализа синтезированных соединений соответствуют вычисленным значениям.
Результаты исследования и их обсуждение
Энергию Гиббса активации реакции (ΔGр.) находили по разности энергий переходного состояния (ΔG (TS)) и реагентов (ΔG (реагентов)) по формуле [4]:
ΔGр. = ΔG (TS) – ΔG (реагентов). (1)
Расчёт константы равновесия (Кравн.) реакции проводили по формуле, найденной из уравнения изотермы Вант-Гоффа [5]:
ΔGр. = – R×T×ln Кравн. = – 8,31×T×2,303×lg Кравн.
В результате: lg Кравн. = – ΔGр. /19,15×T.
Кравн. = 10 lg К равн.. (2)
На протекание химической реакции оказывают влияние: изменение энергии Гиббса в ходе химической реакции (ΔGреакц) и константа равновесия химической реакции (Кравн.), если:
Кравн. = 1, то ΔGреакц = 0, и протекание реакции равновероятно в обе стороны.
Кравн. > 1, то ΔGреакц < 0, и реакция смещена в сторону образования продуктов.
Кравн. < 1, то ΔGреакц > 0, реакция протекает преимущественно в сторону образования реагентов, то есть преобладает обратная реакция.
Нами выполнен расчёт термодинамических параметров соединения I в среде этанола при 25 °С: Кравн. > 1 (402,23) и ΔGр. < 0 (–14,86 кДж/моль) (табл. 1) – реакция смещена в сторону образования продукта. Экспериментальный выход соединения I по методике 1 при этих условиях составил 46 % (табл. 2).
Таблица 2
Результаты модификации методики синтеза соединений I и II
|
Соед. |
t °C реакции |
25 |
79 |
25 |
100 |
120 |
|
Растворитель |
Этанол |
Уксусная кислота + ДМСО (1:1) |
||||
|
I |
Выход, % |
46 |
10 |
15 |
52 |
75 |
|
Т.пл. °C |
139–141 |
139–141 |
139–141 |
139–141 |
139–141 |
|
|
II |
Выход, % |
– |
– |
– |
30 |
80 |
|
Т.пл. °C |
236–238 |
236–238 |
||||
Методика 1 синтеза бензиламида-N-бензоил-5-бромантраниловой кислоты (I). К раствору 0,81 г (0,0027 моль) 6-бром-2-фенил-3,1-бензоксазин-4(3Н)-она в 10 мл 95 %-ного этанола прибавляют раствор из 0,28 г (0,0027 моль) бензиламина в 3 мл 95 %-ного этанола при перемешивании. После выдерживания в течение 1 часа при 25 °С выпадает осадок, который отфильтровывают, высушивают и перекристаллизовывают из этанола. Выход: 0,54 г (46 %), т.пл. = 139–141 °С.
ИК-спектр, νmax, см-1: 3410 (NHCO, CONH); 1675, 1640, 1605 (CONH, NHCO); 1580, 1540, 1510 (CONH, NHCO). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 4,52 д (2H, CH2, J 5,7 Гц); 7,25 д (2H, ArH, J 8,4 Гц); 7,33 т (3H, ArH, J 9,9 Гц); 7.52 т (1H, ArH, J 3,9 Гц); 7,55 д (1H, ArH, J 4,5 Гц); 7.59 т (2H, ArH, J 4,5 Гц); 7,81 д (1H, ArH, J 2,7 Гц); 7,88 д (1H, ArH, J 1,8 Гц); 7,94 д (1H, ArH, J 7,2 Гц); 8,07 с (1H, ArH); 9,40 с (1H, CONH); 12,32 c (1H, NHCO). Найдено, %: C 61,35, 61,90; Н 3,89, 4,39; N 6,54, 7,04. Вычислено, %: С 61,63; Н 4,19; N 6,84.
Повышение температуры реакции в квантово-химических расчётах соединения I до 79 °С приводит к снижению термодинамических параметров: Кравн. > 1 (2,60×10-9) и ΔGр. < 0 (–61,34 кДж/моль), что приводит к снижению выхода соединения I в эксперименте до 10 %.
Для получения 4-метилфениламида N-бензоил-5-йодантраниловой кислоты (II) методика синтеза в этаноле не подходит, как при комнатной температуре (25 °C), так и при нагревании до 79 °C: Кравн. от –1,98×1015 до –4,66×102 < 1 и ΔGреакц в пределах +87,29 – +17,98 кДж/моль > 0 – реакция протекает преимущественно в сторону образования исходных реагентов, о чем свидетельствуют экспериментальные результаты, приведенные в табл. 2.
Авторами [6] проведен ряд экспериментальных исследований по подбору растворителей при синтезе 4-хлоранилида-5-хлорантраниловой кислоты: уксусная кислота, диметилсульфоксид (ДМСО) и использования смеси уксусная кислота: ДМСО (1:1) при температуре 100 °С. Наибольший выход продукта реакции наблюдался при использовании смеси растворителей уксусная кислота: ДМСО (1:1). Выход составил 87,7 %.
На основании анализа проведенных экспериментальных исследований авторам представлялось целесообразным изучить, как повлияет на выход продукта реакции замена растворителя этанола на смесь уксусная кислота: ДМСО (1:1).
Таким образом, чтобы синтезировать соединение II и провести модификацию методики синтеза, необходимо выполнить квантово-химические расчёты с использованием смеси растворителей: уксусная кислота: ДМСО (1:1), методом РСМ с учетом изменения температуры реакционной среды от 25 до 120 °C.
Моделируя условия, при температуре 25 °C, найдены термодинамические параметры по соединению I: Кравн. > 1 (+1,98) и ΔGр. < 0 (–1,70 кДж/моль) (табл. 1) – реакция смещена в сторону образования продукта реакции, что подтверждается экспериментальными данными, выход амида I составил 15 % (табл. 2).
Результаты расчёта соединения II показали смещение равновесия в сторону исходных веществ: Кравн. < 1 (–1,28×1012) и ΔGр. > 0 (+86,48 кДж/моль), реакция не протекает, что подтверждается экспериментальными данными, выход продукта составил 0 %.
Квантово-химические расчёты термодинамических параметров соединения I при температуре 100 °С привели к многократному увеличению константы равновесия в 1275 раз, и составила Кравн. = 2524,88, а энергия Гиббса реакции увеличивается от –1,70 до –19,41 кДж/моль. В эксперименте выход возрастает от 15 до 52 %.
Для модификации условий синтеза соединения II реакцию рассчитали при температуре 100 °С. При этом получено значение константы равновесия Кравн. > 1 (360,76), а также наблюдается переход от эндотермического эффекта к экзотермическому ΔGр. < 0 (–39,69 кДж/моль), реакция смещена в сторону образования продукта, экспериментальный выход составил 30 %.
При повышении температуры до 120 °С при расчётах в смеси уксусная кислота: ДМСО происходит многократное увеличение константы равновесия Кравн. > 1 (1,98×1022 и 1,07×108) и энергии Гиббса ΔGр. < 0 (–158,00 и –57,35).
По результатам проведенных квантово-химических расчетов при температуре 120 °С в смеси уксусная кислота: ДМСО, авторы модифицировали методику синтеза, заменив этанол на смесь уксусная кислота: ДМСО, и увеличили температуру реакции до 120 °С.
Проведенный эксперимент показал увеличение выхода 75 и 80 % соответственно для соединений I и II (методика 2).
Методика № 2 синтеза на примере бензиламида-N-бензоил – 5-бромантраниловой кислоты (I). К смеси 0,60 г (0,0020 моль) 6-бром-2-фенил-3,1-бензоксазин-4(3Н)-она и 0,32 г (0,0030 моль) бензиламина добавляют 4 мл ДМСО и 4 мл ледяной уксусной кислоты, нагревают до температуры 120 °С, затем смесь охлаждают до комнатной температуры, добавляют воду очищенную, выпавший осадок отфильтровывают, высушивают и перекристаллизовывают из смеси этанол: этилацетат (1:1).
Выход: 0.81 г (75 %), т.пл. = 139–141 °С.
ИК-спектр, νmax, см-1: 3410 (NHCO, CONH); 1675, 1640, 1605 (CONH, NHCO); 1580, 1540, 1510 (CONH, NHCO). Спектр ЯМР 1Н (ДМСО-d6), δ, м,д,: 4,52 д (2H, CH2, J 5,7 Гц); 7,25 д (2H, ArH, J 8,4 Гц); 7,33 т (3H, ArH, J 9,9 Гц); 7,52 т (1H, ArH, J 3,9 Гц); 7,55 д (1H, ArH, J 4,5 Гц); 7,59 т (2H, ArH, J 4,5 Гц); 7,81 д (1H, ArH, J 2,7 Гц); 7,88 д (1H, ArH, J 1,8 Гц); 7,94 д (1H, ArH, J 7,2 Гц); 8,07 с (1H, ArH); 9,40 с (1H, CONH); 12,32 c (1H, NHCO), Найдено, %: C 61,35, 61,90; Н 3,89, 4,39; N 6,54, 7,04. Вычислено, %: С 61,63; Н 4,19; N 6,84.
4-Метилфениламид-N–бензоил–5-йодантраниловой кислоты (II) получен по методике № 2. К смеси 0,69 г (0,002 моль) 6-йод-2-фенил-3,1-бензоксазин-4(3Н)-она и 0,32 г (0,0030 моль) бензиламина добавляют 4 мл ДМСО и 4 мл ледяной уксусной кислоты, нагревают до температуры 120 °С, затем смесь охлаждают до комнатной температуры, добавляют воду очищенную, выпавший осадок отфильтровывают, высушивают и перекристаллизовывают из смеси ацетонитрил: этилацетат (1:1). Выход: 0,72 г (80 %), т.пл. = 236–238 °С. ИК-спектр, νmax, см-1: 3330 (NHCO, CONH); 1670, 1630, 1615 (CONH, NHCO); 1570, 1540 (CONH, NHCO). Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 2,31 с (3Н, CH3); 7,19 д (2Н, ArH, J 8,4 Гц); 7,56–7,62 м (5H, ArH, J 18,0 Гц); 7,93 д (2H, ArH, J 6,6 Гц); 7,96 с (1H, ArH); 8,25 д (1H, ArH, J 1,5 Гц); 8,37 д (1H, ArH, J 8,4 Гц); 10,58 с (1Н, CONH); 11,81 c (1H, NHCO). Найдено, %: C 53,35, 57,90; Н 3,59, 4,96; N 5,85, 6,34. Вычислено, %: С 55,80; Н 3,76; N 6,14.
Выводы
Получены теоретические результаты расчёта в среде этанола для соединения I, которые показали низкую скорость протекания реакции при температуре 25 °С, повышение температуры до 79 °С не приводит к увеличению скорости реакции, а наоборот, снижает.
Выполнен теоретический расчёт при использовании смеси уксусная кислота: ДМСО и повышении температуры реакционной среды до 120 °С, в результате произошло многократное увеличение константы равновесия Кравн. > 1 по соединениям I и II (1,98×1022 и 1,07×108).
Таким образом, на основании полученных в ходе работы экспериментальных данных можно сделать вывод, что предложенная методика получения замещенных амидов на основе 6-бром(6-йод) 2-фенил-3,1-бензоксазин-4(3Н)-онов при температуре 120 °С в смеси уксусная кислота: ДМСО позволяет увеличить выход продуктов I и II до 75 % и 80 % соответственно.
Предложенный вариант подхода позволил теоретически обосновать оптимальные условия синтеза и экспериментально подтвердить максимальный выход продукта реакции.
Библиографическая ссылка
Андрюков К.В., Коркодинова Л.М. ТЕОРЕТИЧЕСКИЙ ПОДХОД К ПОИСКУ УСЛОВИЙ СИНТЕЗА 4-МЕТИЛФЕНИЛ(БЕНЗИЛ)АМИДОВ N-БЕНЗОИЛ-5-БРОМ (5-ЙОД)АНТРАНИЛОВЫХ КИСЛОТ НА ОСНОВЕ РАССЧИТАННЫХ ТЕРМОДИНАМИЧЕСКИХ ПАРАМЕТРОВ // Успехи современного естествознания. 2018. № 7. С. 9-14;URL: https://natural-sciences.ru/ru/article/view?id=36795 (дата обращения: 07.01.2026).



